关于护脐带产品技术指导原则编写说明的医疗器械注册咨询
日期:2020-07-09 / 人气: / 来源: / 编辑:Sasha一、指导原则编写的原则
(一)本指导原则编写的目的是用于指导和规范第二类医疗器械产品护脐带注册申报过程中审查人员对注册材料的技术审评。

(二)本指导原则旨在让初次接触该类产品的注册审查人员对产品机理、结构、主要性能、预期用途等各个方面有个基本了解,同时让技术审查人员在产品注册技术审评时把握基本的尺度,对产品安全性、有效性作出系统评价。
二、指导原则编写的依据
(一)《医疗器械监督管理条例》
(二)《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)
(三)《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)
(四)《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令第10号)
(五)《医疗器械标准管理办法》(国家药品监督管理局令第31号)
(六)关于印发《境内第一类医疗器械注册审批操作规范(试行)》和《境内第二类医疗器械注册审批操作规范(试行)》的通知(国食药监械〔2005〕73号)
(七)关于印发《豁免提交临床试验资料的第二类医疗器械目录(试行)的通知》(国食药监械〔2011〕475号)
(八)国家食品药品监督管理部门发布的其他规范性文件
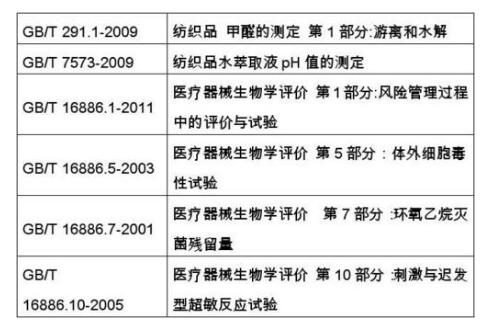
(九)现行的国家标准和行业标准
三、指导原则的编写格式
指导原则正文的层次和目录遵从国家食品药品监督管理部门的统一要求,语言表述采取提示方式,以利于审评人员直入审查内容。
四、指导原则中部分具体内容的编写考虑
(一)产品的主要技术指标及工作原理的制定征求了临床专家的意见。
(二)产品的预期用途综合了已批准上市产品的核准范围及临床专家的意见。
(三)GB/T 19000系列标准把某些不能由随后的产品检验和试验来充分证实其结果的生产过程称之为“特殊”。灭菌就是这样一个特殊过程。因为其过程的功效不能通过对产品的检验来证实。因此,灭菌过程需在用前确认,过程的性能需进行常规监测。医疗器械只有当使用了一个确认过的灭菌过程,才可以标示“无菌”。因此,当医疗器械产品采用环氧乙烷灭菌以无菌形式供应时,除了要求环氧乙烷残留量和无菌指标符合标准要求外,还应同时提交《灭菌确认报告》和灭菌批的《常规控制记录文件》。
五、指导原则编写人员
本指导原则的编写成员包括江西省食品药品监督管理局医疗器械产品注册行政审批人员、技术审评人员、质量检验人员;省内医院有关临床专家、江西省纤维检验局专家;相关企业技术人员等。旨在充分利用各方信息和资源,综合考虑指导原则中各项内容,尽量保证指导原则正确、全面、实用。在编写过程中,得到了有关省市食品药品监督管理局的大力协助。
温馨提示,本站部分内容来源网络,如有侵权,请联系删除!

道和思源(北京)科技有限公司成立于2014年,专注于医疗器械法规咨询服务,致力于为客户将安全、有效和合规的医疗器械产品迅速推向并占领全球市场,是中国领先的医疗器械CRO创新服务企业。主要服务项目有:进口一类医疗器械备案、进口二类医疗器械注册、进口三类医疗器械注册、国产三类医疗器械注册、医疗器械软件注册、临床实验、创新医疗器械申报港澳台医疗器械注册等。
- 上一篇:听力计注册技术审查指导原则
- 下一篇: 生物可吸收冠状动脉药物洗脱支架 动物实验指导原则
猜你喜欢
- 一次性使用乳腺定位丝注册技术 审查指导原则2020-07-14
- 医用二氧化碳培养箱注册技术审查 指导原则2020-06-29
- B群链球菌核酸检测试剂注册技术审查指导原则(2021年第24号)2021-05-17
- 血清淀粉样蛋白A检测试剂注册技术审查指导原则(2020年第80号)2021-05-13
- 神经和心血管手术器械通用名称命名指导原则2021-08-31
- 特定蛋白免疫分析仪注册技术审查指导原则(2020年第80号)2021-05-14
- 泌乳素检测试剂注册技术审查指导原则(2020年第80号)2021-05-14
- 《眼科器械通用名称命名指导原则》最新版全文2022-06-06
- 辅助生殖用穿刺取卵针注册技术审查指导原则2020-05-15
- 医用臭氧妇科治疗仪注册技术审查指导原则2020-04-30
- 医用磁共振成像系统同品种临床评价技术审查指导原则(2020年修订版)(2021年第12号)2021-05-14
- 超声洁牙设备注册技术审查指导原则2020-04-27
- 医疗器械动物实验研究技术审查指导原则2020-05-14
- 关于护脐带产品技术指导原则编写说明的医疗器械注册咨询2020-07-09
- 心脏射频消融导管产品注册技术审查指导原则2020-04-13
- 肺炎支原体IgM_IgG抗体检测试剂注册技术审查指导原则(2021年第4号)2021-05-13











