创新医疗器械产品如何申请注册?(小微企业创新医疗器械特别审批程序)
根据中国医疗器械注册的要求,在中国境内注册的医疗器械具备相应条件,可以对需要注册的医疗器械进行创新和优先申请,然后在进行相关的注册活动时,可以取得检验、临床、审评和审批优先的权利,从而对医疗器械加速上市提供保障。

本文主要从以下4个方面说起:
1、小微企业创新医疗器械收费
2、创新医疗器械相关法规政策
3、申请创新医疗器械特别审批的相关要求
4、创新医疗器械注册流程
1、小微企业创新医疗器械收费
根据《国家药品监督管理局行政许可事项收费目录》可知,小微企业提出的创新医疗器械产品首次注册申请,免收其注册费。
对符合《中小企业划型标准规定》(工信部联企业〔2011〕300号)条件的注册申请人,申请小微企业收费优惠政策时向受理和举报中心提交下述材料:
1.《小型微型企业收费优惠申请表》(见附件2附表);
2.企业的工商营业执照副本;
3.上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具);
4. 由国家食品药品监督管理总局医疗器械技术审评中心出具的创新医疗器械特别审批申请审查通知单。
2、创新医疗器械相关法规政策
1.关于医疗器械审评检查长三角、大湾区分中心开展审评业务及器审中心咨询工作安排调整的通告(2021年第6号)
2.关于发布创新医疗器械特别审查程序的公告(2018年第83号)
3.总局关于发布创新医疗器械特别审批申报资料编写指南的通告(2016年第166号)
4.关于发布《医疗器械应急审批程序》的公告(2021年第157号)
5.《创新医疗器械特别审批程序》
3、申请创新医疗器械特别审批的相关要求
申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
4、创新医疗器械注册流程
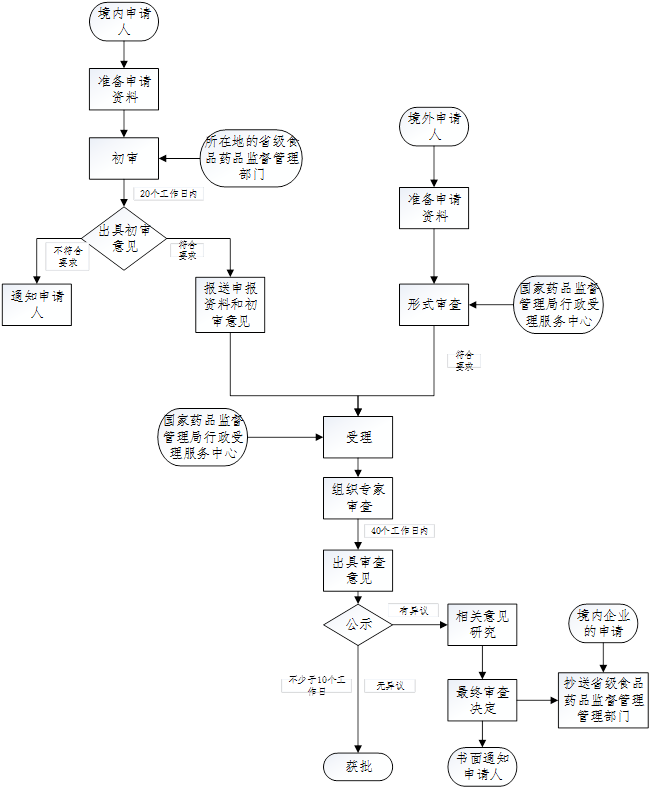
创新医疗器械申报流程图
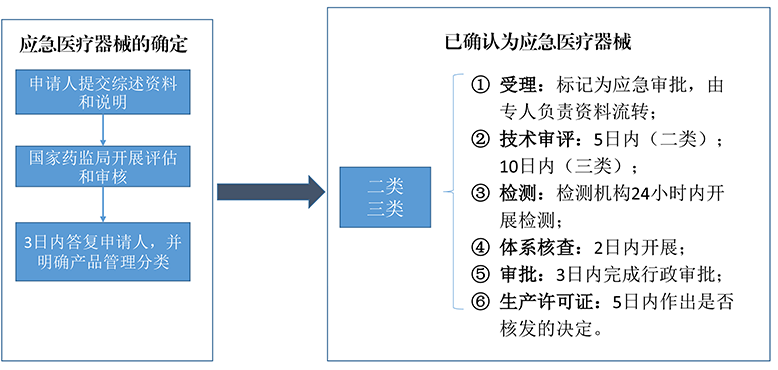
创新医疗器械sh审评流程
相关问题
什么是应急审批:
当社会存在突发公共卫生事件威胁以及突发公共卫生事件发生时,为有效预防、及时控制和消除突发公共卫生事件危害,确保应急所需医疗器械能够尽快完成注册审批的程序。
哪些医疗器械在应急审批范围:
对突发公共卫生事件应急所需在我国境内尚无同类产品上市,或虽在我国境内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要经国家药监局确认的境内第三类和进口第二类、第三类医疗器械的审批。


