一类医疗器械备案/变更/收费标准【境外】

一类医疗器械备案申请条件
1:属于第一类医疗器械产品目录的产品(2014年第8号通告附件或已通过国家局分类界定后属于第一类医疗器械的产品(已录入国家局审批系统);
2:办理第一类医疗器械备案申请事务的人员应当受生产企业委托,并具有相应的专业知识,熟悉医疗器械注册、备案相关的法律、法规、规章和技术要求;
3:申请备案的第一类医疗器械,产品技术要求需符合{国家食品药品监督管理总局关于发布医疗器械产品技术要求编写指导原则的通告(第9号)};
4:资料要求需符合(国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告)(第26号)的备案资料形式要求。
道和思源为客户提供
一类产品备案保过体系和X7省时系统
一类产品备案资料的收集和评估
一类产品备案资料的撰写和符合
一类产品备案资料的递交
一类产品生产场地的备案
一类医疗器械变更注册
备案事项属于当地相关部门职权范围,变更备案资料齐全、符合法定形式要求的,由服务窗口当场予以备案,发给变更后的第一类医疗器械生产备案凭证;变更备案资料不齐全或者不符合规定形式的,应当一次告知备案人需要补正的全部内容;对不予变更备案的,应当告知备案人并说明理由;对备案事项不属于当地相关部门职权范围的,不予备案,并告知备案人同时说明理由。
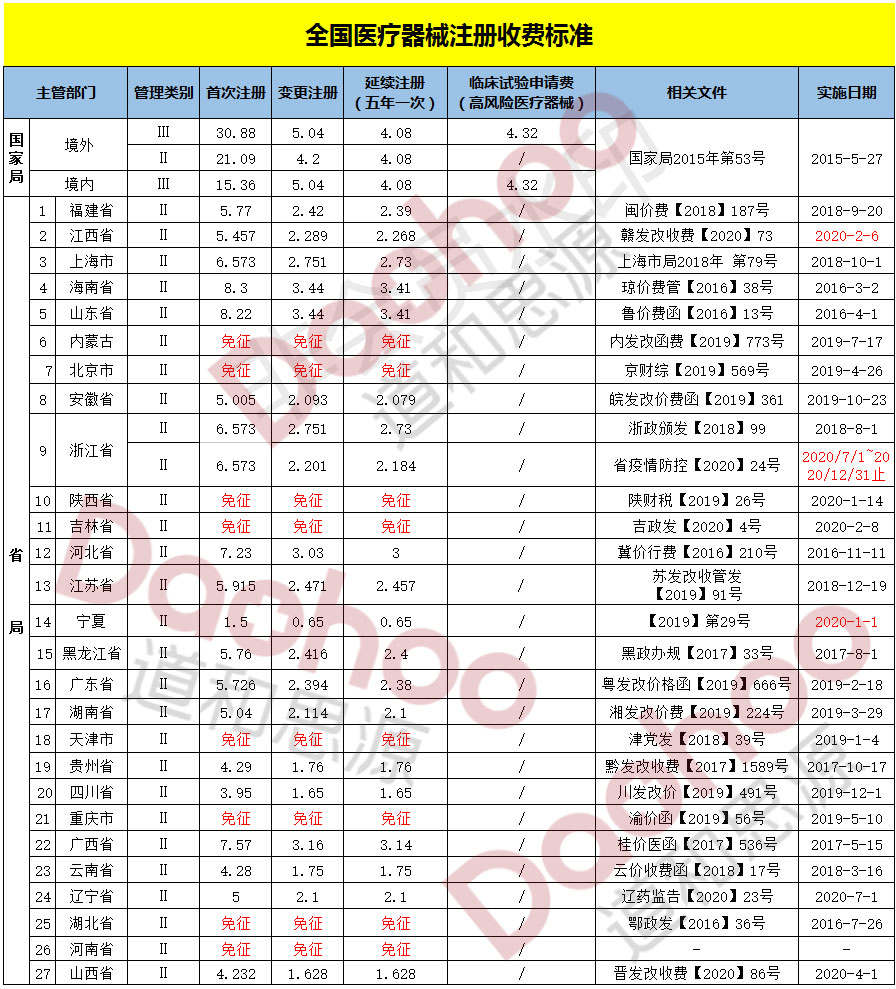
此项服务根据客户的需求定制注册方案,因产品不同、目的不同,研究复杂程度及规模差异很大,请直接与使用在线咨询方式与客服联系,或直接拨打电话13521090701(微信同号)。
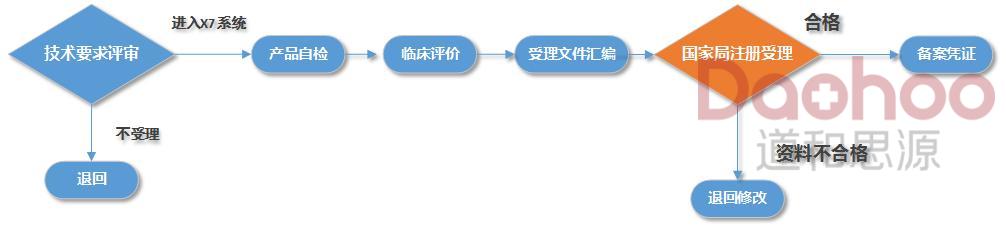
一类医疗器械备案服务流程图