义齿制作用合金产品注册技术审查指导原则
本指导原则旨在指导和规范义齿制作用合金产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围
本指导原则适用于义齿制作用合金。
本指导原则所称的义齿制作用合金属于《医疗器械分类目录》中6863-7金属、陶瓷类义齿材料,管理类别为Ⅱ类。
本指导原则不适用于牙科银汞合金、牙科种植体合金、牙科种植体基台合金、牙科焊接合金、正畸用金属合金、牙科器械用合金。
二、技术审查要点
(一) 产品名称的要求
义齿制作用合金的命名应至少包含产品的主要成分和功能,对于制作工艺、产品形态等不作强行规定。例如:镍铬烤瓷合金、钴铬支架合金、铸造金钯烤瓷合金、铸造镍铬冠桥合金、钴铬烤瓷合金、钴铬烤瓷合金粉(烧结用)等。
(二) 产品的结构和组成
应标明质量分数大于1.0%的合金元素名称(或符号)。例如:镍铬烤瓷合金主要由镍(Ni)、铬(Cr)、钼(Mo)、硅(Si)元素组成,并含少量的锰(Mn)、铁(Fe)、镓(Ga)。
(三)产品的工作原理
利用金属良好的机械性能、化学稳定性、物理性能、加工性能,产品经过铸造、切削、烧结、烤瓷等工艺制成定制式义齿。
(四)产品适用的相关标准
表1 相关产品标准
| 标准编号 | 标准名称 |
| GB/T 1.1-2009 | 《标准化工作导则 第1部分:标准的结构和起草规则》 |
| GB/T 191-2008 | 《包装贮运图示标志》 |
| GB/T 222-2006 | 《钢的成品化学成分允许偏差》 |
| GB/T 228.1-2010 | 《金属材料 拉伸试验 第1部分:室温试验方法》 |
| GB/T 230.1-2009 | 《金属材料洛氏硬度试验 第1部分:试验方法(A、B、C、D、E、F、G、H、K、N、T标尺)》 |
| GB/T 1423-1996 | 《贵金属及其合金密度的测试方法》 |
| GB/T 1425-1996 | 《贵金属及其合金熔化温度范围的测定 热分析试验方法》 |
| GB/T 2828.10-2010 | 《计数抽样检验程序 第10部分:GB/T 2828计数抽样检验系列标准导则》 |
| GB/T 3850-1983 | 《致密烧结金属材料与硬质合金密度测定方法》 |
| GB/T 4339-2008 | 《金属材料热膨胀特征参数的测定》 |
| GB/T 4340.1-2009 | 《金属材料 维氏硬度试验 第1部分:试验方法》 |
| GB 8653-2007 | 《金属杨氏模量、弦线模量、切线模量和泊松比试验方法(静态法)》 |
| GB/T 9937.2-2008 | 《口腔词汇 第2部分:口腔材料》 |
| GB/T 16886.1-2011 | 《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》 |
| GB/T 16886.3-2008 | 《医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验》 |
| GB/T 16886.5-2003 | 《医疗器械生物学评价 第5部分:体外细胞毒性试验》 |
| GB/T 16886.10-2005 | 《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》 |
| GB/T 16886.11-2011 | 《医疗器械生物学评价 第11部分:全身毒性试验》 |
| GB/T 17168-2008 | 《牙科铸造贵金属合金》 |
| YY 0620-2008 | 《牙科学 铸造金合金》 |
| YY 0621-2008 | 《牙科金属 烤瓷修复体系》 |
| YY 0626-2008 | 《贵金属含量25%-75%的牙科铸造合金》 |
| YY/T 0127.4-2009 | 《口腔医疗器械生物学评价 第2单元: 试验方法 骨埋植试验》 |
| YY/T 0127.9-2009 | 《口腔医疗器械生物学评价 第2 单元:试验方法 细胞毒性试验:琼脂扩散法及滤膜扩散法》 |
| YY/T 0127.10-2009 | 《口腔医疗器械生物学评价 第2单元:试验方法 鼠伤寒沙门氏杆菌回复突变试验(Ames试验)》 |
| YY/T 0127.13-2009 | 《口腔医疗器械生物学评价 第2单元:试验方法 口腔粘膜刺激试验》 |
| YY/T 0127.15-2009 | 《口腔医疗器械生物学评价 第2单元:试验方法 亚急性和亚慢性全身毒性试验:经口途径》 |
| YY/T 0268-2008 | 《牙科学 口腔医疗器械生物学评价 第1单元:评价与试验》 |
| YY/T 0466.1-2009 | 《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》 |
| YY/T 0528-2009 | 《牙科金属材料 腐蚀试验方法》 |
| ISO 1562:2004 | Dentistry—Casting gold alloys |
| ISO 9693:2006 | Metal—Ceramic dental restorative systems |
| ISO 10271:2001 | Dental metallic materials—Corrosion test methods |
| ISO 22674:2006 | Dentistry—Metallic materials for fixed and removable restorations and appliances |
上述标准包括了注册产品标准中经常引用到的标准。应允许企业根据产品的特点和用途,引用适宜的其他国际标准或行业外的标准。
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品标准时与产品相关的国家、行业标准是否进行了引用,以及引用是否准确。可以通过对注册产品标准中“规范性引用文件”是否引用了相关标准,以及所引用的标准是否适宜来进行审查。此时,应注意标准编号、标准名称是否完整规范,年代号是否有效。
其次对引用标准的采纳情况进行审查。即所引用的标准中的条款要求,是否在注册产品标准中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
(五)产品的预期用途
在本指导原则中,依据机械性能(见下表3)将金属材料分为6种类型,这6种类型金属材料的预期用途举例如下:
—0型:用于承受低应力的单牙固定修复体,如小贴面单面嵌体、贴面冠。
注:用电解成型法或烧结法制作金属烤瓷冠用的金属材料属于0型。
—1型:用于承受低应力的单牙固定修复体,如有贴面或无贴面的单面嵌体、贴面冠。
—2型:用于单牙固定修复体,如冠和嵌体(不限制表面数量)。
—3型:用于多单位固定修复体,如桥。
—4型:用于承受极高应力的附有薄型部件的修复体,如可摘局部义齿、卡环、薄贴面冠、跨度大或横截面小的桥体、杆、附着体以及种植体的上部结构。
—5型:用于需要高硬度和高强度的修复体,如薄的可摘局部义齿、横截面小的部位、卡环。
(六)产品的主要风险
义齿制作用合金应符合YY/T 0316-2008《医疗器械 风险管理对医疗器械的应用》的有关要求,审查要点包括:
1.产品定性定量分析是否准确;
2.危害分析是否全面;
3.风险可接收准则,降低风险的措施及采取措施后风险的可接收程度,是否有新的风险产生。
根据YY/T 0316-2008附录E列举了“义齿制作用合金”可能存在的危害分析见下表2,企业还应根据自身产品特点确定其他危害。针对产品的各项风险,企业应采取应对措施,确保风险降到可接受的程度。
表2 危害分析举例
| 危害类型 | 危害的形成因素 | 危害处境 | 可能的后果 |
| 能量危害 | 原材料不符合要求、配料不正确 | 材料强度不够 | 无法正常使用,操作失败 |
| 生物学危害 | 生物个体差异 | 生物不相容(金属离子过敏) | 牙龈刺激、红肿、过敏等 |
| 未按照生产工艺配方而引入有害元素 | 不正确的配方 | 牙龈刺激、红肿、过敏等 | |
| 环境危害 | 未按照规定存储或运行 | 存储或运行偏离规定环境条件 | 无法正常使用,操作失败 |
| 意外磕碰或者咀嚼过硬食物 | 意外的机械破坏 | 崩瓷、卡环变形、断裂等 | |
| 与医疗器械使用有关的危害 | 操作说明不规范 | 不适当的操作说明 | 无法正常使用,操作失败 |
| 操作者不熟悉 | 由不熟练/未经培训的人员使用 | 无法正常使用,操作失败 | |
| 生物个体差异 | 对副作用的警告不充分 | 牙龈刺激、红肿、过敏等 | |
| 加工过程中的危害 | 铸造、喷砂、打磨等过程中吸入粉尘 | 粉尘危害 | 呼吸系统疾病、尘肺病等 |
(七)产品的主要技术指标
本章给出义齿制作用合金产品需要考虑的基本技术性能指标,企业可参考相应的标准,根据企业自身产品的技术特点和用途制定相应的性能指标。如国家标准中有不适用条款,企业在标准的编制说明中必须说明理由。
1.外观尺寸:应明确产品外观尺寸要求。
2.化学成分:
(1)主要元素:至少标明大于1.0%(质量分数)的成分含量,精确至0.1%。0.1%~1.0%之间的成分需标出名称或符号。
(2)允许成分偏差:贵金属及银合金中每种成分含量与标明值偏差不大于0.5%。非贵金属含量大于20%的成分与标明值偏差不大于2.0%,1.0%~20%的成分与标明值偏差不大于1.0%。
(3)有害元素:铍≤0.02%,镉≤0.02%,另外镍>0.1%需要指出含量,精确至0.1%。
3.机械性能:
(1)金属材料的机械性能要求:见下表3。
表3 金属材料的机械性能
| 类型 |
0.2%规定非比例延伸 强度Rp0.2(MPa) |
断裂延伸率(%) | 弹性模量(GPa) |
| 0 | - | - | - |
| 1 | ≥80 | ≥18 | - |
| 2 | ≥180 | ≥10 | - |
| 3 | ≥270 | ≥5 | - |
| 4 | ≥360 | ≥2 | - |
| 5 | ≥500 | ≥2 | ≥150 |
(2)金瓷结合强度:生物材料与至少一种指定陶瓷的分离/断裂起始强度应大于25Mpa(此要求仅适用于金属-烤瓷修复体用金属材料)。
4.物理性能:
(1)密度:与标明值偏差不大于±5%。
(2)固相线和液相线温度或熔点:1200℃以上,与标明值偏差不大于±50℃,1200℃以下,与标明值偏差不大于±20℃。
(3)维氏硬度:与标明值偏差不大于±10%。
(4)线胀系数:与标明值偏差不大于0.5×10-6K-1(此要求仅适用于金属-烤瓷修复体用金属材料)。
5.化学性能:
(1)耐腐蚀性:金属材料在(37±1)℃、(7.0±0.1)d释放到指定溶液中的总金属离子不超过200μg/cm2。
(2)抗晦暗:暴露到指定的晦暗环境,如仅有极轻微的颜色改变,并轻轻擦刷即可很容易地除去合金上的锈蚀物,则产品可以描述为“抗晦暗”。
6.生物相容性:
按YY/T 0268-2008《牙科学 口腔医疗器械生物学评价 第1单元:评价与试验》要求进行。一般要求评价产品的:
(1)细胞毒性
(2)口腔粘膜刺激性(或皮内反应)
(3)急性全身毒性(经口途径)
(4)迟发型超敏反应
(5)亚慢性(亚急性)全身毒性(经口途径)(暂不对贵金属合金提出此要求)
(6)遗传毒性
(八)产品的检测要求
产品的检测包括出厂检验和型式检验。
1.出厂检验:出厂检验项目至少应包括上述主要技术指标中的1、2、4(1)、4(3)四项。
2.型式检验:型式检验由有资质的检验机构进行。型式检验时,按相应的标准要求进行,所有适用条款应全部合格。
3.试验方法
3.1 外观尺寸
用游标卡尺、千分尺或其他通用量具进行测量。
3.2 化学成分
化学成分按GB/T 15072.1—20 贵金属合金化学分析方法进行试验或使用标准分析方法(EDS、AAS、ICP-AES/MS、ICP-AOS/MS)进行试验。
3.3 机械性能
(1)金属材料的机械性能:
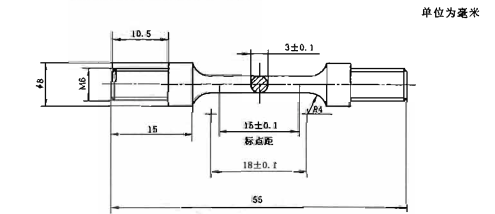
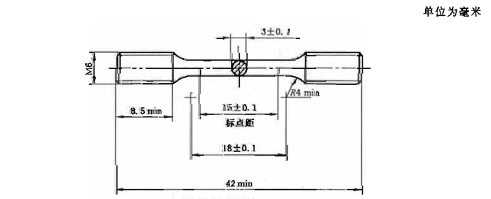
图1 金属机械性能试样
按照图1制备6个标准试样进行试验,制备试样时需要避免热缩孔等缺陷。对于明显离群数据,应判断是否为试样的缺陷导致。使用万能力学性能试验机,以(1.5±0.5)mm/min的十字头速率对样品施加载荷,直到样品断裂,用机械引伸计或激光引伸计测试并计算0.2%规定非比例延伸强度。
在试验中断裂的同一样品上测定断裂延伸率。
采用力学试验的试件,方法同0.2%非比例延伸极限强度。根据引伸计的延伸记录和试验机的应力记录计算出弹性模量。
若4个或4个以上试样符合要求,计算这些试样的平均值,作为这些试样的0.2%规定非比例延伸强度。
若符合要求的试样少于4个,应重新进行试验。
若在重新试验中,符合要求的试样仍少于4个,则该金属材料此项不合格。
(2)金瓷结合强度:
按厂家提供的制作金属-烤瓷修复体的金属基体的加工程序说明书制备6个合金/金属试样,尺寸为(25±1)mm×(3±0.1)mm×(0.5±0.05)mm。按说明书对试样进行预处理;然后再按厂家说明书,将遮色底瓷对称地涂覆在每个金属试样的3mm宽的一侧表面上,遮色底瓷长(8±0.1)mm;在每个试样上再涂覆牙本质瓷,使烧结后烤瓷的总厚度为(1.1±0.1)mm,陶瓷的形状为长方形。然后按说明书对每个试样进行上釉烧结。
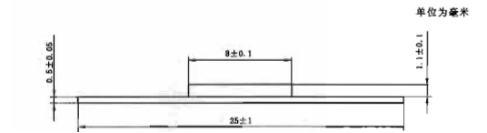
图2 金属-烤瓷试样示意图
将烧结完成的试样放在万能力学性能试验机上(两支点间距离20mm,压头刃口曲率半径1.0mm),试样的烤瓷面对称地位于加荷面的反面。以(1.5±0.5)mm/min的恒定速率施力,记录力值,直至断裂。测量6个试样中每个试样的烤瓷层的一端发生剥离时的断裂力Ffail(N)。若试样是从烤瓷层的中间开裂,则应舍弃该试样,重新制备试样并试验,直至完成6个试样的测试。
断裂力Ffail得乘以一个常数k,常数k能从图3中找到。常数k是金属底层dM(0.5±0.05)mm厚度的函数,即使用的金属材料的杨氏模数Em的值。
为了从某一厚度dM找k的值,首先对适当的EM值选择曲线,然后从厚度dM选择的曲线找到k的值 。

图3 确定作为金属基体厚度dM和金属材料杨氏模量EM的函数的系数k的曲线图
剥离/初始断裂强度τb使用公式计算:τb=k. Ffail
如果4个或4个以上的样品能满足要求,金属-陶瓷体系通过测试。
如果少于4个样品能满足要求,重新试验。
如果再一次少于4个样品能满足要求,那么金属-陶瓷体系没有通过测试。
3.4 物理性能
(1)密度:
按照GB/T 1423-1996《贵金属及其合金密度的测试方法》或GB/T 3850-1983 《致密烧结金属材料与硬质合金密度测定方法》或其他标准方法进行试验。
(2)固相线和液相线温度或熔点:
按照GB/T 1425-1996 《贵金属及其合金熔化温度范围的测定 热分析试验方法》进行试验;或采用冷却曲线法、差热分析(DTA)或其他精度为10℃的方法进行试验。
对于钛和其他纯金属,可采用熔点、线热膨胀和密度的受控文献数据。
(3)维氏硬度:
维氏硬度按照GB/T 4340.1-2009 《金属材料 维氏硬度试验 第1部分:试验方法》进行试验。
(4)线胀系数:
按加工说明书,制备2个金属试样,试样为棒状或条状,横截面积约30 mm2~65mm2(例如长20mm ~25mm,直径为6mm~8mm的圆柱或截面边长为8mm的矩形试样),磨平试样的两端,两端互相平行并垂直于试样的中轴。
分别制备4个遮色底瓷、4个牙本质瓷和4个牙釉质瓷试样。其中,每种瓷粉的2个试样在真空下烧结1次,再在大气压力下的空气中烧结1次。每种瓷粉的另外2个试样在真空中烧结3次,在大气压力下的空气中再烧结1次。
用热膨胀仪分别测量每个试样,热膨胀仪以5℃/min的升温速率加热,直至达到软化点温度。从测量得到的绘图曲线或膨胀-温度曲线的记录值确定每个样品从25℃到500℃之间的线胀系数。
计算并报告金属材料在25℃~500℃之间的线胀系数α25℃~500℃的平均值和分别经2次烧结和4次烧结的陶瓷在25℃~500℃之间的线胀系数α25℃~500℃的平均值。精确到0.1×10-6/K。
对于钛和其他纯金属,可采用线热膨胀的受控文献数据。
3.5 化学性能
(1)耐腐蚀性:
按照YY/T 0528-2009《牙科金属材料腐蚀试验方法》进行试验。
(2)抗晦暗:
暴露到试验的晦暗环境后,如果仅有极轻微的颜色改变,并经轻轻地擦刷即可很容易地去除合金上的锈蚀物,则产品具有抗晦暗性。
按说明书制备2个抗晦暗试验样品,直径约为10mm,至少0.5mm厚;对试样用标准金相制样方法磨样和抛光;在乙醇中超声波清洗样品2min,用水漂洗样品,并用无油无水空气吹干。在温度为(23±2)℃将试样夹持在能每分钟将样品浸入抗晦暗试验溶液中10~15s的装置上,在容器中放入用分析纯的水和硫化钠现配制的0.1mol/L的硫化钠溶液,将样品浸没。开启试样装置,试验持续(72±2)h。分别在(24±1)h和(48±1)h更换试验溶液,在(72±2)h从浸泡装置中取出样品,用水彻底清洗样品,把样品浸泡在乙醇中,然后取出用无油无水的空气吹干。
在正常或无放大作用的矫正视力、至少1000lx的光照度和不超过25cm的距离下目视检查,比较经试验和未经试验样品表面的损蚀差别。
3.6生物相容性
依据标准YY/T 0268-2008的规定按照附录A中表面接触器械C类选择试验项目进行生物学评价。
(1)细胞毒性试验:
按照标准GB/T 16886.5-2003 《医疗器械生物学评价 第5部分:体外细胞毒性试验》或YY/T 0127.9-2009 《口腔医疗器械生物学评价 第2单元:试验方法 细胞毒性试验》:琼脂扩散法及滤膜扩散法进行试验。
(2)口腔粘膜刺激性(或皮内反应)试验:
口腔粘膜刺激性按照标准YY/T 0127.13-2009 《口腔医疗器械生物学评价 第2单元:试验方法 口腔粘膜刺激试验》进行试验。
皮内反应试验按照标准GB/T 16886.10-2005 《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》进行试验。
(3)急性全身毒性(经口途径)试验:
按照标准GB/T 16886.11-2011 《医疗器械生物学评价 第11部分:全身毒性试验》进行试验。
(4)迟发型超敏反应试验:
按照标准GB/T 16886.10-2005 《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》进行试验。
(5)亚慢性(亚急性)全身毒性(经口途径)试验(暂不对贵金属合金提出此要求):
按照标准YY/T 0127.15-2009 《口腔医疗器械生物学评价 第2单元:试验方法 亚急性和亚慢性全身毒性试验:经口途径》进行试验。
(6)遗传毒性试验:
按照标准GB/T 16886.3-2008 《医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验》或YY/T 0127.10-2009 《口腔医疗器械生物学评价 第2单元:试验方法 鼠伤寒沙门氏杆菌回复突变试验(Ames试验)》进行试验。
(九)产品的临床要求
1. 若申报准产注册的义齿制作用合金产品,其主要化学成分和功能与已上市产品相同的,企业可以不提交临床试验资料,但应提交与已上市同类产品(同类产品合法上市,其注册证在有效期之内)的对比说明,并得出与已上市的同类产品实质性等同的结论,其内容一般包括:
(1)产品的基本原理、临床预期用途(如使用的目的、对象、方法、环境等);
(2)产品的化学成分及质量分数、主要性能指标(如维氏硬度,固相线和液相线温度或熔点,机械性能,耐腐蚀性等);
(3)产品使用方法、使用中的禁忌、警告内容等。
注:已上市的同类产品是指经食品药品监督管理部门许可批准的产品,并提交该产品的注册证及注册登记表所列相关信息。
2. 若申报准产注册的义齿制作用合金产品,其主要化学成分和功能在市场上没有相同产品注册上市的,企业应进行临床试验,并应符合《医疗器械临床试验规定》及《医疗器械注册管理办法》附件12的要求,同时可参考《无源植入性医疗器械产品注册申报资料指导原则》。考虑到义齿制作用合金在型式试验中已根据YY/T 0268-2008附录A中,表面接触器械C类选择试验项目进行了生物相容性试验,因此临床试验应主要考虑评价义齿制作用合金对义齿临床性能的实现及影响。
2.1临床试验的目的
义齿制作用合金在进行临床试验时,应明确叙述其临床试验目的,确保试验结果能够被直接观察。且检测指标应客观,且偏倚误差最小,与义齿的临床功能有直接联系。
2.2临床试验的样本量、受试者纳入标准及排除标准
2.2.1 样本量
应给出总样本量及样本量的计算方法,同时应列出每病种临床试验例数及其确定理由。在多中心临床试验中,每个临床试验机构的最低和最高的受试者数量。
2.2.2纳入及排除标准
应当在临床研究方案中规定完善合理的受试者纳入标准及排除标准;原则上,对不符合纳入标准及符合排除标准的入选者应当予剔除。临床试验中,所选择的病例应能代表并充分反映注册单元的临床使用范围。同时,对受试者的描述包括并不只限于以下条目:
(1)姓名、性别、年龄等基本信息;
(2)药物史、疾病史等的健康状况潜在因素;
(3)肝功、肾功等生理生化检查指标;
(4)黏膜、咬合、牙体或牙列缺失缺损等口腔内软硬组织的情况;
(5)是否有不良咬合习惯、不良嗜好等;
(6)知情同意的相关信息。
2.3 临床试验的检查项目
临床试验的检查项目应能充分体现义齿制作用合金用于义齿制作后,合金性能对义齿临床指标的影响。主要检查项目包括并不只限于下列条目:
2.3.1固定义齿
(1)适合性:临床检查固定义齿金属部分精度是否满足临床要求,包括边缘密合、就位正常等。
(2)金瓷结合性能:临床检查固定义齿是否出现瓷层崩裂且裂隙延伸至金属-陶瓷交界处,或大块瓷层脱落的现象。
(3)色稳定性:临床检查固定义齿的合金部分是否出现肉眼可见的色泽变化,如变暗、失去金属光泽等。
(4)生物安全性:密切关注患者的不良反应,包括局部及全身性的过敏、炎症等。
(5)牙体情况:检查受试者的牙体情况是否正常,包括:牙体是否有变色,叩痛;牙周状况(牙周袋、BOP等);口腔粘膜状况;X线片检查等。
2.3.2活动义齿
(1)适合性:临床检查活动义齿金属部分精度是否满足临床要求,包括适合性、就位及取戴是否正常等。
(2)力学性能:临床检查活动义齿金属部分力学性能是否满足临床要求,包适弹性、刚度等。
(3)色稳定性:临床检查活动义齿的合金部分是否出现肉眼可见的色泽变化,如变暗、失去金属光泽等,同时应检查活动义齿的塑料基托及人工牙是否被金属离子染色。
(4)生物安全性:密切关注患者的不良反应,包括局部及全身性的过敏、炎症等。
(5)牙体情况:检查受试者的牙体情况是否正常,包括牙体是否有变色、叩痛,牙周状况(牙周袋、BOP等),口腔粘膜状况,X线片检查等。
2.4 临床试验的检查时间点
临床试验应检测受试者试验前(基线)、佩戴该金属材料制作的义齿后第1、7、14、30、90、180天多个时间点进行检查。
2.5 临床试验的分组、数据制表及统计分析
2.5.1分组:考虑到义齿制作用合金临床试验的特殊性,可考虑不设对照组,采用单一试验组,对受试者的情况进行评价计分并进行汇总。
2.5.2数据制表及统计分析:应当对所有受试者报告表中的数据进行制表,包括未完成调查受试者资料的副本,将临床试验数据进行统计分析,记录统计分析的方法及结果。应当根据试验设计类型、比较类型、资料性质和统计分析目的,合理选择统计分析方法,并对所用的统计学方法,必须引用参考目录或列出公式,并对任何变更进行解释。
2.6临床试验结束后,所出具的临床试验报告应符合临床试验方案的要求,其中具体内容应符合《医疗器械临床试验规定》的相关规定。
2.6.1临床试验报告内容应与临床试验方案内容保持一致,尤其注意明确以下内容:试验产品的产品名称、规格型号及所对应的试验病例数;试验产品的临床适用范围/适应证、禁忌证与注意事项。
2.6.2临床试验报告中应明确失访例数及失访原因。
2.6.3临床试验报告中需报告所有不良事件和不良反应发生的时间、发生的原因、结果及与试验用品的关系。对于所采取的措施及受试者的愈后需予以明确记录说明。
2.6.4临床试验报告中应明确临床试验结论。必要时要随临床报告同时提交用于统计分析的数据库。
(十一)产品的不良事件历史记录
暂未收到相关不良事件报告。
(十二)产品说明书、标签和包装标识
产品说明书、标签和包装标识的编写要求应符合《医疗器械说明书、标签和包装标识管理规定(国家食品药品监督管理局令第10号)》和YY/T 0466.1-2009 《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》的要求。同时应注意以下要求:
1.产品名称
1.1 产品名称应与本指导原则中“产品名称要求”一节相一致;
1.2产品如有商品名称,商品名称的表述不能与本指导原则中“产品名称要求”一节相冲突或相违背。
2. 产品的性能、参数、技术指标
产品应标明规格型号和预期用途,同时应标注如下性能指标及参数:
2.1产品应标示金属材料的组成成分:质量分数大于0.1%的每种元素都应声明,质量分数大于 1.0%的每种成分都应注明其质量分数,精确至 0.1%;
2.2 标示0.2%规定非比例延伸强度;
2.3 标示断裂延伸率;
2.4 标示弹性模量;
2.5 标示密度;
2.6 标示产品具有抗晦暗的声明,若适用;
2.7 标示液相线和固相线温度或熔点;
2.8 标示线胀系数,如果产品用于制作金属烤瓷修复体;
2.9 标示推荐的铸造温度,如果产品作为铸造合金或者金属烤瓷合金;
2.10 标示推荐的最高烧结温度,如果产品用于制作金属烤瓷修复体;
2.11标示如果金属材料用于制作金属烤瓷修复体,应说明加工条件,并提供与至少一种匹配(指定)的符合 ISO 9693 的陶瓷材料达到满意结合的表面预备的说明。
3. 禁忌证:
禁忌证应至少包括:对金属元素过敏患者。
应标明注意事项以及其他需要警示或者提示的内容。
3.1 产品禁忌证和注意事项应与临床试验资料、专家评审意见或前次注册核准的内容一致;
3.2 产品应标示关于潜在副作用的详细信息并标注“本产品含镍”,如果产品中的镍含量超过 0.1 %(质量分数);
3.3 标示操作说明;
3.4 标示如果使用说明书中推荐软化或硬化,应提供热处理说明;
3.5 标示在研磨时预防粉尘吸入的建议;
3.6 说明书中不应含有《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令第10号)中规定的不得标明的内容。
4.产品的运输、储存
4.1 产品的运输和储存条件应与产品标准规定的一致。
(十三)注册单元的划分原则
不同金属组成、相同金属组成不同质量分数范围或不同功能的义齿制作用合金应分别注册。义齿制作用合金可根据产品的形状、尺寸来区分型号规格。
(十四)同一注册单元中典型产品的确定原则和实例
同一注册单元内,典型产品作为被检测的产品,是指能够代表本注册单元内其他产品安全性和有效性的产品,其结构最复杂、风险最高。
例如:可选取产品工艺、结构相对最复杂的形状/尺寸的型号规格作为典型产品进行型式检测。
三、审查关注点
(一)关于产品名称: 义齿制作用合金的命名应至少包含产品的主要成分和功能,对于制作工艺、产品形态等不作强行规定,企业可以根据实际需要考虑是否需要规定。
(二)关于典型产品选取:典型产品应是同一注册单元内能够代表本单元内其他产品安全性和有效性的产品,应考虑功能最齐全、结构最复杂、风险最高的产品。应选取典型产品进行型式检验。
(三)关于产品的结构组成:应声明合金中含量大于0.1%(质量分数)的所有成分,对含量大于1.0%(质量分数)的所有成分,应声明每种成分并精确至0.1%(质量分数)。
(四)关于产品主要技术性能指标:主要技术性能指标是否执行了强制性国家标准和行业标准,是否引用了适用的推荐性标准。
(五)关于产品的风险分析:主要风险是否已经列举,并通过风险控制措施使产品的风险在合理可接受的水平之内。
(六)关于产品的说明书:产品说明书是否符合《医疗器械说明书、标签和包装标识管理规定》及相关国家标准、行业标准的规定。必须告知用户的信息是否完整。
义齿制作用合金产品注册技术审查指导原则编制说明
一、指导原则编写的原则
(一)本指导原则编写的目的是用于指导和规范第二类义齿制作用合金产品注册申报过程中审查人员对注册材料的技术审评。
(二)本指导原则旨在让初次接触该类产品的注册审查人员对产品机理、结构、主要性能、预期用途等各个方面有个基本了解,同时让技术审查人员在产品注册技术审评时把握基本的尺度,对产品安全性、有效性作出系统评价。
二、指导原则编写的依据
(一)《医疗器械监督管理条例》
(二)《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)
(三)《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)
(四)《医疗器械说明书、标签和包装标志管理规定》(国家食品药品监督管理局令第10号)
(五)《医疗器械标准管理办法》(国家药品监督管理局令第31号)
(六) 关于印发《境内第一类医疗器械注册审批操作规范(试行)》和《境内第二类医疗器械注册审批操作规范(试行)》的通知(国食药监械〔2005〕73号)
(七)国家食品药品监督管理部门发布的其他规范性文件
三、指导原则中部分具体内容编写的考虑
(一)关于产品命名和注册单元划分
决定产品性能的关键因素是合金的成分,且不同用途的合金产品对于性能的要求也截然不同。本指导原则要求产品命名需要明确标示出合金的主要成分和功能,注册单元也按照产品不同的形状、尺寸来区分型号规格。
随着科学技术的不断进步,许多新的成型工艺在义齿制作中得到了大量的应用,并取得了良好的效果。因此,本指导原则在产品命名和注册单元划分上对工艺、产品形态不作具体的规定。
(二)关于义齿制作用合金参考标准引用
义齿制作用合金现行有效标准主要包括以下4个:YY 0620-2008《牙科学 铸造金合金》、YY 0626-2008 《贵金属含量25%~75%的牙科铸造合金》、GBT 17168-2008 《牙科铸造贵金属合金》、YY 0621-2008《牙科金属-烤瓷修复体系》,这4个标准不包括对非贵金属合金的要求,且各标准的性能指标要求又不尽相同。
ISO22674-2006《Dentistry - Metallic materials for fixed and removable restorations and appliances》,此标准是取代了ISO1562:2004和ISO8891:1998(YY 0620-2008、YY 0626-2008、GB/T 17168-2008均是根据这两个标准翻译或修订而得)之后的一个综合版本,且要求更为严格,现已等同转化为国家标准,尚处于报批阶段。
故在制定本指导原则时,主要性能指标和检测项目仍依据标准YY 0620-2008 《牙科学 铸造金合金》、YY 0621-2008 《牙科金属 烤瓷修复体系》、YY 0626-2008 《贵金属含量25%~75%的牙科铸造合金》、GB/T 17168-2008 《牙科铸造贵金属合金》中的要求,并参照YY 0621-2008《牙科金属 烤瓷修复体系》标准,增加了贵金属与非贵金属成分含量的偏差的区分、线热膨胀系数、金瓷结合强度检测项目。
但对义齿制作用合金的分类、机械性能、硬度、密度、化学性能等要求,采纳了ISO 22674:2006的规定。其中,对硬度的要求不再以类别区分,统一要求为“与标示值偏差不大于±10%”;对密度的要求由“应在标示值的±0.5g/cm3”修改为“与标示值偏差不大于±5%”。
对于烤瓷修复用合金,其金瓷结合性能须满足YY 0621-2008《牙科金属-烤瓷修复体系》。
另外,因为贵金属合金本身性能比较稳定,目前在临床使用中也暂未收到相关不良事件报告,故暂不对贵金属合金按照YY/T 0268-2008 《牙科学 口腔医疗器械生物学评价 第1单元:评价与试验》提出检测亚慢性(亚急性)全身毒性(经口途径)的要求。
同时,按照YY/T 0268-2008 《牙科学 口腔医疗器械生物学评价 第1单元:评价与试验 》附录A规定,对于“大于30天的持久接触的表面接触器械”要进行亚慢性毒性试验,可不进行急性全身毒性试验检测。但考虑到GB/T 16886.11-2011《医疗器械生物学评价 第11部分:全身毒性试验》的“5.1 总则”中指出:急性毒性试验可作为亚急性/亚慢性和其他试验确定剂量接触方式的初试步骤,并且可提供物质预期临床接触途径毒性作用模式方面的信息。在本指导原则中,因为有贵金属类义齿用合金可暂不进行亚慢性毒性试验的定论,故在没有进行亚慢性毒试验的前提下,建议选择“急性全身毒性试验”作为对可能存在的风险进行监控的目的。在GB/T 16886.1-2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》和《YY/T 0268-2008 《牙科学 口腔医疗器械生物学评价 第1单元:评价与试验 》附录A中都有指出:“表A.1是一个评定性程序的框架,不是一个核查清单。”故对义齿制作用合金提出检测急性全身毒性的要求。
(三)义齿制作用合金作为生产定制式义齿的原材料,已有很长临床使用历史和很多临床使用证据,临床预期用途和作用机理是明确的。决定合金产品性能的关键因素是合金的成分和功能,通过强化合金物理化学性能检测及生物相容性方面的评价,可以合理判断合金的安全有效性。但考虑到合金虽然出厂时不直接作用于人体,但用于制作的定制式义齿成品注册已不需要进行临床试验,如果合金也不进行临床试验,可能有潜在的安全风险。因此,我们对义齿制作用合金的临床资料提出如下要求:
1.若申报准产注册的义齿制作用合金产品,其主要化学成分和功能与已上市产品相同的,企业可以不提交临床试验资料,但应提交与已上市同类产品(同类产品合法上市,其注册证在有效期之内)的对比说明。
2.若申报准产注册的义齿制作用合金产品,其主要化学成分和功能在市场上没有相同产品注册上市的,企业应进行临床试验。
在临床试验检查项目的确定上,本指导原则分别就固定义齿和活动义齿,列出了适合性、色稳定性、生物安全性、力学性能和牙体情况等几个主要的检查指标。所选评判项目是实际临床工作中较常用且能表征义齿性能的几个指标,其中 “适合性”是义齿是否能满足临床使用的最为重要的条件之一。适合性是否满足需要,与义齿制作用合金的理化性能密切相关:例如,在义齿的生产制作中的合金铸造工序,合金经加热从固态转换为液态后再从液态转变为固态,温度从室温加热至900℃以上再下降至室温。在这种剧烈变化的冶金过程中,合金的铸造流动性、应力的释放、相位的变化等理化性能,均会对这一过程产生决定性的影响,最终将直接影响义齿的适合性,因此需要对其进行检测。为排除技师操作、制作工艺、包埋材料质量等因素的影响,临床检测过程中所用定制式义齿,应交由具有相应资质的定制式义齿生产企业制作完成。
本指导原则意在通过义齿的临床性能,检查制作义齿所用的合金能否满足临床要求,从而对合金的技术指标进行判断。在临床试验分组方法的确认上,由于定制式义齿作为定制式产品,其情况多变且复杂,每一例义齿均是独一无二的,因此设置空白对照组的临床试验方法,不适用于义齿合金的临床试验。因此本指导原则未设计空白对照实验组,而改为检查各个检查时间点所试验合金各项指标的通过率。在临床试验检查时间点的制定上,本指导原则制定了义齿戴入后第1、7、14、30、90、180天多个时间点进行检查。这些时间点的选择主要是根据目前已有的医用类材料临床试验的检测时间点确认。
在审查操作中,应排除因制作原因影响评判结果的情况。
四、指导原则编写人员
本指导原则的编写成员由四川省食品药品监督管理局医疗器械产品注册行政审批人员、四川省食品药品安全监测及评审认证中心医疗器械产品注册技术审评人员、四川大学国家生物医学材料工程技术研究中心研究人员、四川医疗器械生物材料和制品检验中心检测专家、四川大学制造科学与工程学院技术人员、四川大学华西口腔医院临床专家、四川省相关生产企业代表组成,以充分利用各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则正确、全面、实用。

