软性接触镜临床试验指导原则
附件2
软性接触镜临床试验指导原则
随着科学技术的不断发展,软性接触镜产品日益增多。为了进一步规范该类产品上市前的临床试验,并指导该类产品申请者/生产企业在申请产品注册时临床试验资料的准备,特制订本指导原则。
本指导原则虽然为该类产品的临床试验及申请者/生产企业在申请产品注册时临床试验资料的准备提供了初步指导和建议,但是不会限制医疗器械相关管理部门对该类产品的技术审评、行政审批以及申请者/生产企业对该类产品临床试验资料的准备工作。
随着软性接触镜材料的进步以及眼科相关诊治技术的发展、相关法规政策和标准的更新,本指导原则还会不断地完善和修订。
一、适用范围
按照《医疗器械注册管理办法》规定需在国内进行上市前临床试验的日戴软性接触镜注册申报项目,可参考本指导原则制定临床试验方案并实施。
本指导原则适用于采用光学成像原理、矫正屈光不正的日戴软性接触镜(不含采用柱镜设计针对散光进行矫正的软性接触镜)。特殊功能设计的软性接触镜产品须结合申报产品自身特点另行制定其上市前临床试验方案。
二、基本原则
软性接触镜的临床试验应符合《医疗器械临床试验质量管理规范》及其他相关法律、法规的规定。
进行上市前临床试验的软性接触镜应已经过相对科学的实验室研究和动物实验验证,且研究结果可基本证明产品安全、有效。
三、临床试验方案
(一)临床试验目的及注意事项
软性接触镜产品的临床试验目的是评价申报产品是否具有预期的临床安全性和有效性。在临床试验中推荐使用标准对数视力表,也可使用标准对数视力表。应采用标准的方法检查视力。如为多中心临床试验,不同的临床试验机构中使用的视力表须一致。同时涉及屈光度检查时,均应以受试者主觉验光值(包括球镜度及柱镜度)为准,客观验光数值(包括球镜度及柱镜度)应记录并作为参考。
因临床方案是阐明试验的总体设计、试验目的、试验方法和步骤等内容的文件,应当***大限度地保障受试者的安全和健康,应当由申办者和研究者按规定的格式共同设计制定,报伦理委员会批准后实施,若有修改,必须重新经伦理委员会批准。
(二)临床试验设计
以申请软性接触镜上市为目的的临床试验应是前瞻性、随机对照临床试验,临床试验应当在两个或者两个以上医疗器械临床试验机构中进行,如按照同一临床试验方案在3个以上(含3个)临床试验机构实施的临床试验将视为多中心临床试验。对照用医疗器械应选择境内已经批准上市的同类产品,应考虑其主要功能原理与受试产品一致,配戴方式一致,配戴周期相同,镜片材料相似,不建议采用历史对照或非平行对照。
(三)临床试验样本量
主要评价指标:戴镜有效率。有效定义:戴镜一周时分别检查两眼矫正视力均大于等于5.0(标准对数视力表)为“有效”。
根据对照用软性接触镜的相应指标的循证医学相关资料做出检验假设并计算样本量。同时,样本量的确定与选择的假设检验类型(优效、非劣效、等效性检验)及I、II类错误和具有临床意义的界值(疗效差)有关,同时还应考虑预计排除及临床失访的病例数。
临床试验样本量的确定应当符合临床试验的目的和统计学要求,并且完成所有访视的受试者不应少于本指导原则中规定的***低样本量。目前,软性接触镜产品的有效性、安全性的评估均应采用临床上通用的评价标准,每个评价病例应该是完整的双眼数据,临床试验***终完成总样本量不少于120例,非劣效界值不大于10%,试验组不少于60例。
(四)临床试验随访时间
不同产品的临床试验随访时间不完全一致,随访时间的确定应该具有医学文献资料支持,要有医学共识。
目前,软性接触镜的临床试验至少应分别于戴镜当天和戴镜1周、1个月、3个月进行随访观察。(可结合试验产品的临床观察具体情况设定更为频繁的观察时间)
(五)入选标准
试验组和对照组需采用统一的入选标准和排除标准,要求受试者分别检查两眼,框架镜***佳矫正视力均能达到5.0。其他入选标准和排除标准的具体内容由临床试验负责单位具体讨论决定。
(六)临床观察指标
1.有效性评价项目。
视力:框架镜***佳矫正视力、接触镜矫正视力
可使用我国标准对数视力表检查受试者的框架镜***佳矫正视力和接触镜矫正视力(远用)并记录。
2.安全性评价项目。
(1)眼部情况:在临床试验期间要求定期随访观察眼部的变化,包括:裸眼视力(远用)、眼睑、睑缘、泪液膜、结膜、角膜、前房、虹膜、瞳孔、晶状体、眼底、眼压等,在临床观察期间需严密监控并记录临床并发症的发生,随访次数由申办者与研究者在研究方案中确定,原则上不能少于3次。
(2)镜片配适状态:初次配戴及定期随访中需观察镜片在眼表的位置(中心定位)、覆盖度、松紧度、活动度,并评价和记录其等级。
(3)镜片状态:在定期随访中观察镜片的污损情况如:沉淀、变形、变色、锈斑、划痕、破损等。
(4)屈光状态:屈光度和角膜曲率,应提供受试者戴镜前、后的屈光度变化(球镜度及柱镜度)和角膜曲率变化。
目前软性接触镜的临床常规疗效评价指标可参考附录Ⅰ和附录Ⅱ
(七)确定护理系统
根据受试产品的特性选择适合的并已经在我国批准上市的护理产品,要求试验组与对照组使用相同的护理用品。
在定期随访中同时观察镜盒中护理液和瓶中护理液有无混浊、杂质、沉淀及对眼睛的刺激症状等。
(八)临床随访观察内容
在随访中对软性接触镜产品的有效性、安全性、舒适性等方面进行评估。(随访评估内容可参考附录Ⅲ)
四、统计分析报告和临床试验报告
(一)统计分析报告
应将所有中心的数据合并在一起进行统计分析,并出具总的统计分析报告。应对随机对照部分进行统计分析,并出具相应的统计分析报告。统计分析报告应至少包括如下4部分内容:
1.临床试验完成情况描述:包括临床试验概况(筛选人数、入组人数、完成试验人数、失访/退出/剔除人数等)。
2.基线描述:应对所有入选受试者的基线人口统计学指标、生命体征及其他相关病史指标等进行描述。
3.疗效/效果评价:应对全分析集和符合方案集分别进行统计分析。
4.安全性评价时,应对接受过治疗的所有受试者进行分析,不能遗漏所有发生的任何不良事件。同时,详细描述每一病例出现的全部不良事件的具体表现、程度、预后及其与研究产品的关系。
(二)临床试验报告
各临床试验单位在遵循统一临床试验方案基础上,由临床试验申办者与研究者根据基于所有入选受试者的总的统计分析报告,出具临床试验报告。各临床试验单位出具临床试验小结。各临床试验单位不需要单独出具分中心统计报告。临床试验报告内容包括:试验目的、试验假设、主要评价指标、评价方法、对照品、入选/排除标准、样本量及计算依据、受试者资料、试验质量控制措施、数据管理及质控措施、试验结果、伴随治疗、不良事件、并发症及其处理、试验结论、适用范围、禁忌症和注意事项、存在问题及改进意见等。
此外,需注意以下问题:
1.临床试验报告应与临床试验方案保持一致。
2.明确所有病例是否全部完成随访,所有接受了器械治疗的病例是否均纳入***终的统计分析,失访病例需明确失访原因。
3.报告所有不良事件发生的时间、原因、后果及与试验用器械的关系,对于所采取的处理措施需予以明确。
五、参考文献:
1.《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
2.《医疗器械临床试验质量管理规范》(国家食品药品监督管理总局 中华人民共和国国家卫生和计生委员会令第25号)
3.《关于发布医疗器械临床评价技术指导原则的通告》(国家食品药品监督管理总局通告2015年第14号)
4.瞿佳.《视光学理论和方法》人民卫生出版社 2004
5.葛坚.《眼科学》人民卫生出版社 2005
6.Premarket Notification (510(k)) Guidance Document For Daily Wear Contact Lenses. (美国FDA)
六、起草单位
本指导原则由国家食品药品监督管理总局医疗器械技术审评中心起草并负责解释。
附录I
接触镜临床试验眼部观察指标
一、结膜观察
(一)睫状充血
可按下列分级
0级 正常 无充血
1级 轻度 轻度睫状充血(角膜周边轻度整体充血)
2级 中度 明显睫状充血(明显的局限性充血)
3级 重度 严重的睫状充血(角膜周边严重充血)
(二)球结膜充血
可按下列分级
0级 正常 无充血
1级 轻度 轻度弥漫性充血
2级 中度 明显的局限性或弥漫性充血
3级 重度 弥漫性的巩膜浅层充血
(三)球结膜镜片压迹/凹陷:0为无,1为有。
(四)睑结膜观察
睑结膜***大反应位置可按下述分级记录:
0级 正常 结膜面均匀光泽
1级 轻度 直径小于1mm的轻微或散在的乳头或滤泡
2级 中度 a)直径小于1mm的明显乳头或滤泡
b)1个乳头顶端染色
3级 重度 a)直径1mm或以上局限性或弥漫性的乳头或滤泡
b)1个以上乳头顶端染色
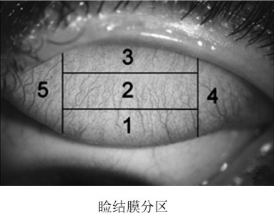
另外,睑结膜反应按五个睑结膜区域分别记录(见下图):将睑结膜纵向分为4份,内1/4为5区,外1/4为4区,中间2/4为1,2,3区。将中间2/4区再横向分为三等分,靠近穹隆侧为1区,中间为2区,靠近睑缘侧为3区。
二.角膜观察
(一)角膜水肿
1. 上皮水肿
0级 正常 无水肿,角膜清晰透明
1级 轻度 上皮轻度雾状混浊
2级 中度 明显的局部或整体上皮雾状混浊
3级 重度 广泛的上皮云雾状混浊,可能出现大泡
大泡的存在与否必须说明,同时说明它们的数量。出现大泡必须看作可报告的4级严重上皮水肿。
2. 基质水肿
基质水肿可按下列分级:
0级 正常 无水肿
1级 轻度 轻度角膜中心混浊,瞳孔边缘清晰可见
2级 中度 角膜混浊,瞳孔边界模糊可见或有后弹力层皱折。
3级 重度 角膜中心混浊,瞳孔边界不可见出现明显后弹力层皱褶
(二)角膜上皮微囊
0级 无 裂隙灯后部反光照射下未发现微囊泡。
1级 轻度 中心或旁中心区角膜少量微囊,少于于30个,表面无染色和其他异常。
2级 中度 多量微囊出现,多于30个,并有融合,可伴有明显染色或干燥斑。
3级 重度 大量微囊出现,大于50个,并融合成片,伴有明显染色或上皮糜烂。
(三)角膜内皮多形性变化(图1)
0 级 无 细胞密度高(通常高于2500/mm2),大小均匀,规则六角形内皮镶嵌,CV值(形态变异系数)<25,六角形细胞比例>65%。
1级 微度 偶有个别内皮细胞增大,25≤CV值≤30,60%≤六角形细胞比例≤65%。
2级 轻度 个别内皮细胞增大,形态仍较规则,30<CV值≤35,55%≤六角形细胞比例<60%。
3级 中度 内皮细胞增大,密度有所降低,细胞大小分布不均匀,形态不规则,35<CV值≤40,50%≤六角形细胞比例<55%。
4级 重度 内皮细胞明显增大,密度明显降低(低于2000/mm2),大小显著不同,形态极不规则,CV值>40,六角形细胞比例明显降低,即六角形细胞比例<50%。
注:当所测得的CV值、六角形细胞比例未能分在同一级别时,应取两个数值对应级别中高的级别。

图1 角膜内皮细胞多形性改变分级
(四)角膜新生血管形成
角膜新生血管按血管伸入角膜透明区的范围分级:
0 = 无 无血管延伸
1 = 微度 <1mm血管延伸
2 = 轻度 ≥1mm至≤1.5mm血管延伸
3 = 中度 >1.5 mm至≤2mm血管延伸
4 = 重度 血管延伸>2mm
另外,血管延伸的深度和位置可做如下述报告
深度:a)表层
b)基质层
位置:N鼻侧 T颞侧
I下方 S上方
C全周 X其他的(需具体描述)
(五)角膜浸润
角膜点状浸润可按下列分级:
0级 正常 无浸润
1级 微度 少于5个点状浸润
2级 轻度 大于5个少于8个点状浸润
3级 中度 > 8个点状浸润
4级 重度 出现片状浸润或深基质浸润
(六)角膜的其他损害
1.角膜糜烂
局部全层角膜上皮细胞缺损。
2.周边角膜溃疡
呈圆形,在炎症浸润的基础上全层上皮缺损,位于角膜周边区。
3.感染性角膜溃疡
明显充血,全层角膜上皮缺失,基质炎症和坏死,位于角膜的中央区或旁中央区。
附录Ⅱ
视觉、屈光和接触镜性能以及
主观可接受程度的评价程序
一、概述
临床方案如包括这些程序,应考虑下述分类。
二、视觉性能
为评价视觉性能,应测量视力。另外,在有眩光光源时,也应测试低对比的视力、对比敏感度和视觉性能。
三、屈光性能
应提供受试者戴镜前、后的屈光度变化(球镜度及柱镜度)。
四、角膜散光测量
应记录受试者角膜强弱主径线曲率及角膜散光度和散光轴位的结果。
五、接触镜的配戴特性
(一)概述
可使用下述分类评价接触镜眼内配戴特性。
(二)镜片中心定位
镜片在角膜上的稳定位置,应按如下3分值记录:
0 = ***佳镜片中心定位
1= 可接受的非中心定位
2= 不可接受的非中心定位
(三)镜片移动
应记录镜片的移动。
眨眼后立即记录相对于镜片的基础位置的镜片移动。
下睑上推,镜片复位运动的结果,用下列数字记录:
-2 = 不可接受的移动过小
-1 = 可接受的移动过小
0 = ***佳移动
+1 = 可接受的过度移动
+2 = 不可接受的过度移动
六、镜片表面特性
(一)前表面湿润度
0 = 反射面光滑均匀
1 = 表面粗糙模糊,在每一眨眼瞬间看起来清晰,凝视时变得模糊。
2 = 表面有局限性干燥斑(不湿润)
3 = 镜片表面不湿润
(二)前表面沉淀物
0 = 无 表面清洁
1 = 微度 仅在泪液干燥后可见
2= 轻度 易去除的可见沉淀物
3= 中度 不可去除的沉淀物
4 = 重度 不可去除的沉淀物,影响舒适度
(三)后表面沉淀物
0 = 无 表面清洁
1 = 微度 3点或更少的可去除微粒
2 = 轻度 ***多至10点的可去除微粒
3 = 中度 3点或更少的不可去除沉积
4 = 重度 4点或更多的沉积物和(或)角膜压迹
七、主观可接受程度
(一)舒适度
0 = 疼痛,不能接受镜片
1 = 非常不舒服,有强烈刺激或不耐受
2 = 轻微不舒服,有刺激性或不耐受
3 = 舒适,有镜片存在感但无刺激感
4= 非常舒服,偶有镜片存在感
5= **,无镜片存在感
(二)视觉
0 = 不可接受,镜片不能配戴
1 = 很差,视力不良,不可接受
2 = 差,视力模糊,但可接受
3 = 好,偶尔视力模糊,但可接受
4 = 很好,轻微视物模糊,可接受
5 = **,无视觉模糊
(三)可操作性
0 = 极差,不能对镜片操作
1 = 很差,有困难和非常偶尔才能成功戴上和取出
2 = 差,有困难,偶然地戴上和取出成功
3 = 好,有一些问题,但通常能成功地戴上和取出
4 = 很好,偶尔有镜片戴上和取出困难
5 = **,镜片的戴上和取出没问题
(四)镜片的清洁性
0 = 极差,不能清洁镜片
1 = 很差,基本不能清洗干净镜片
2 = 差,有困难,偶然清洁困难
3 = 好,有一些问题,但通常能清理干净镜片
4 = 很好,偶尔有清洁困难
5 = **,镜片处理很干净
附录Ⅲ
随访和评估
| 随访时间 | 评 估 项 目 | |||||||
|
1.配镜前和戴镜当天基础检查 2.发放镜片及护理产品 |
裸眼视力 |
矫正 视力 |
1.眼科常规检查:裂隙灯检查(角膜、结膜、泪液膜),内皮细胞,眼底检查,眼压检查等等 2.屈光状态检查(框架眼镜、接触镜) 3.护理产品过敏测试等 |
1.镜片参数和质量确认 2.护理产品包装、外观及物理性状检查 |
镜片配适状态检查:静态和动态评估 | **使用镜片后自觉症状调查评分 | 按试验需求填写其他检查项目 | |
| 框架镜 | 接触镜 | |||||||
|
戴镜后 1周 |
接触镜矫正视力(需要时进行追加矫正) |
1.眼科常规检查:裂隙灯检查(角膜、结膜、泪液膜),眼底检查,眼压检查等等 2.屈光状态检查 |
1.镜片观察:清洁度、污损、沉淀、变形、变色、锈斑、划痕、破损等 2.护理液检查:混浊、杂质、沉淀等 3.镜盒外观和清洁程度 |
同上 | 自觉症状调查评分 | 其他特殊检查项目 | ||
|
戴镜后 1月 |
同上 | 同上 | 同上 | 同上 | 同上 | 同上 | ||
|
戴镜后 3月 |
同上 | 同上及内皮细胞检查 | 同上 | 同上 | 同上 | 同上 | ||
注:需要将所有镜片回收,并在随访复查时裂隙灯下观察镜片状态。

