关于注射泵产品技术审查指导原则编写说明的医疗器械注册咨询
一、指导原则编写的原则
(一)本指导原则编写的目的是用于指导和规范第二类注射泵产品注册申报过程中审查人员对注册材料的技术审评。
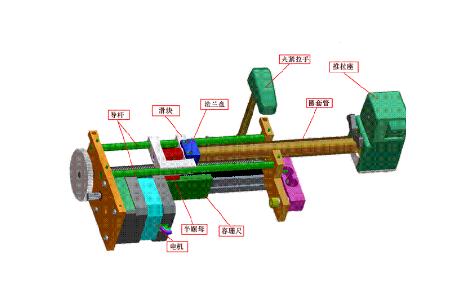
(二)本指导原则旨在让初次接触该类产品的注册审查人员对产品机理、结构、主要性能、预期用途等各个方面有个基本了解,同时让技术审查人员在医疗器械产品注册技术审评时把握基本的要求尺度,以确保产品的安全、有效。
(三)本指导原则中的注射泵产品只包括根据GB 9706.27-2005《医用电气设备 第2-24部分:输液泵和输液控制器安全专用要求》标准中定义的注射泵,即是通过一个或多个单一动作的注射器或类似容器来控制注入患者体内液体流量的设备。
(四)本指导原则中的术语、定义采用GB 9706.27-2005《医用电气设备 第2-24部分:输液泵和输液控制器安全专用要求》标准的术语和定义。
二、指导原则编写的依据
(一)《医疗器械监督管理条例》
(二)《医疗器械注册管理办法》(16号令)
(三)《医疗器械临床试验规定》(5号令)
(四)《医疗器械说明书、标签和包装标识管理规定》(10号令)
(五)《医疗器械标准管理办法》(31号令)
(六)关于印发《境内第一类医疗器械注册审批操作规范(试行)》和《境内第二类医疗器械注册审批操作规范(试行)》的通知( 国食药监械[2005]73号)
(七)国家食品药品监督管理局发布的其他规范性文件
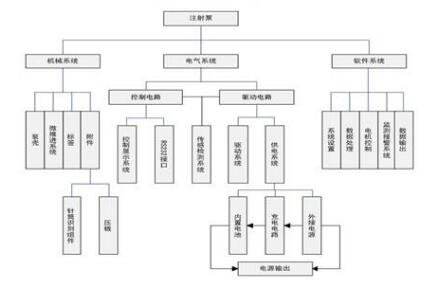
三、指导原则中部分具体内容的编写考虑
(一)产品的结构和组成内容中,给出了典型产品的结构示意图,以便于表述和理解。
(二)在产品的工作原理中,介绍了该类产品的基本原理、产品的结构特点和一般要求。
(三)因产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
(四)产品应适用的相关标准中给出了现行有效的国家标准、行业标准(包括产品标准、基础标准),以及相应的国际标准。为了与标准今后可能的修改相适应,本指导原则只注明标准号,不注明年代。
(五)产品的预期用途采用了《医用电气设备第2-24部分:输液泵和输液控制器安全专用要求》(GB9706.27-2005)“2.108注射泵”定义的表述方式,并结合已批准上市产品的核准范围、公开出版的临床医学文献的描述和临床专家的意见。
(六)产品的主要风险中,参照YY/T0316中附录D,逐项考虑产品自身以及与配套附件使用时可能产生的危害以及危害发生的原因分析。
(七)产品的主要性能指标中给出了产品需要考虑的各个方面,主要提出共性要求,具体量化指标需要参照相关的国家标准、行业标准和生产商技术能力予以确定。
(八)在产品的检测要求中,因为《医疗器械注册管理办法》第二章的规定较明确,本指导原则不再复述。
(九)产品的临床要求中考虑了需要进行临床试验和提供临床试验材料两种情况;同时,根据《医疗器械注册管理办法》附件12的要求,企业可免于提交临床试验材料。
(十)产品的不良事件历史记录主要通过我省不良事件监测机构查询和了解。
四、编写人员
本指导原则的编写成员由浙江省食品药品监督管理局医疗器械产品注册技术审评人员、行政审批人员、国家食品药品监督管理局杭州医疗器械检测中心检验人员、生产企业厂家代表、临床专家共同组成。起草过程中广泛征求了相关省(市)局的意见,以充分利用各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则可操作性和指导性。

