一次性使用球囊子宫支架医疗器械产品注册
一次性使用球囊子宫支架医疗器械产品注册主要风险应按照YY/T 0316《医疗器械 风险管理对医疗器械的应用》进行风险分析。企业在进行风险分析时至少应考虑表2中的主要危害,还应根据自身产品特点确定其他危害。针对产品的各项风险,企业应采取应对措施,确保风险降到可接受的程度,并明确告之剩余风险。
1.与产品有关的安全性特征判定可参考YY/T 0316的附录C。
2.危害、可预见的事件序列和危害处境判断可参考YY/T 0316附录E、I。
3.风险可接收准则,降低风险的措施及采取措施后风险的可接收程度,是否有新的风险产生。
4.医疗器械注册市场上已上市同类产品的不良事件分析总结。审查时可参考不良事件历史记录,重点关注由于潜在设计缺陷导致的抱怨和不良事件,以及相应的风险控制措施。
产表2 球囊子宫支架产品的主要危害
危害分类 危害形成的因素 可能的后果
生物学危害
再次或交叉
感染 一次性使用的产品被再次使用 引起感染、交叉感染
添加剂或加工助剂 在产品中引入的助剂,如使用未经过生物安全性评价的交联剂、粘合剂等。交联剂分解不完全,紫外吸光物质超标。 害
生物
污染 医疗器械注册生产环境污染产品,如外来的纤维、粉尘、细菌等其他杂质;
产品原材料受到污染;
灭菌操作不严格;
包装破损;
使用时操作不正规 产品带菌、热原,引起患者感染
不正确的配方 未按工艺要求进行配料,工艺控制不严格 有可能引起小分子残留量过大,导导致产品安全性不符合要求。
生物相容性 产品不符合生物相容性评价的要求。或者存在个体对材料致敏的可能性。 导致对患者生物相容性的危害,
信息
危害 标记 医疗器械产品注册不完整的产品使用说明书;
对产品性能特征不恰当地描述;
不恰当地对产品预期的使用规范;
对产品注意事项的限制未充分说明。 产品对人体产生危害
操作说明书 产品过于复杂的操作说明;
禁忌证和注意事项描述不清;
警告不明确;
副作用的警告不明显或叙述不清;
没有一次性使用医疗器械可能再次使用时会产生危害的警告。 对人体产生危害或引发其他伤害
不完整的要求产生的危害 对参数的不恰当规范 产品的设计参数不恰当;
产品性能的要求不全面(如:球囊稳定性、导管、接头等要求制定不全面,使用过程中导管断裂,球囊及接头漏液、无法排空球囊中液体等);
未提及产品的货架有效期或不规范。 管身破裂、漏液无法实现预期用途
人为因素产生的危害 由缺乏技术的/未经培训的人员使用。 操作不熟练,操作失误 对人体产生危害或无法实现预期用途。如:放置位置不合适导致球囊子宫支架效果受影响。球囊充起体积超出设计要求,导致球囊破裂、漏液。球囊中生理盐水无法排空导致球囊导管拔出困难。
操作
危害 使用
错误或准备不充分 不正确或不恰当的进行球囊充压;
充压体积不正确的测量;
不遵守产品的使用规则,如使用前检查不充分不全面等;违反常规操作;未按说明书要求使用无齿钳夹持球囊。 对人体产生危害,无法实现预期用途。
失效产生的危害 功能
退化 由于老化、使用过程中产品导管断裂、球囊破裂、漏液等而导致功能退化。 产品性能不符合要求,无法实现预期用途
医疗器械产品技术要求应包括的主要性能指标:
医疗器械注册代理根据《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)的要求,产品技术要求应符合国家标准、行业标准和有关法律、法规的要求。在此基础上,申请人应根据产品的特点制定保证产品安全有效、质量可控的技术要求。产品技术要求及试验方法均应经过验证。常见的技术指标包括以下几点(不限于此):
1.外观与尺寸
1.1 产品外表面应光滑、无毛刺、清洁、无加工缺陷。刻度应清晰可见。
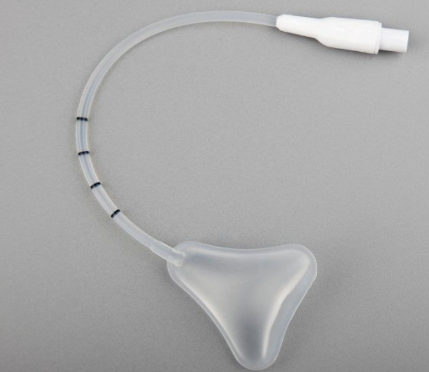
1.2 导管直径、长度、球囊尺寸、容积等应符合设计要求。有效长度L为测量从球囊头端延伸至导管和座的连接处(详见图2)。
2.物理性能
2.1导管及连接部位应具有一定的抗断裂强度,如:应能承受大于等于15N轴向静拉力。
2.2球囊可靠性
当球囊按照标称体积1.5倍充起时,并在37.0±2℃的环境中放置 24h 后,球囊、充起管路及接头均无无泄漏和损坏。
2.3球囊回缩性能
医疗器械产品注册代理注册人球囊按照标称体积充盈,置于37±2℃环境中24小时后,球囊应能有效缩回(建议参考YY 0325-2016附录D球囊液体回收率制定)。
2.4耐弯曲性能
手持软管两标线处弯曲软管,使软管两标线相触,并使标线外1cm长软管平行接触。试验长度内不发生打折(建议参考GBT15812-1995中耐弯曲试验部分制定)。球囊未充盈前折叠后,能充盈张开。
2.5充盈阀的可靠性
对充盈阀的可靠性应提出以下要求:
2.5.1充盈阀圆锥接头应符合GB/T 1962.1的规定,与符合GB/T 1962.1的外圆锥接头配合良好,无明显的摆动。
2.5.2充盈阀应该开合良好,无漏液现象。
2.5.3当抽出球囊内的液体时,充盈阀不应该阻碍球囊放水。
2.6若含有球囊充起组件,应制定相应的性能指标。如:含有充起球囊的注射器,应参考GB15810中适用部分(如:5.1-5.10)制定相应性能指标。
3.化学性能
医疗器械注册咨询根据产品材料特性,由企业决定对化学性能,如:重金属、酸碱度、还原物质(易氧化物)、紫外吸光度、蒸发残渣、过氧化物等提出要求。若灭菌使用的方法容易产生残留,应明确残留物的名称及残留量。
注意:化学性能检验方法中应明确样品的制备方法,样品检验液的制备应符合GB/T14233.1第四部分的要求。
4.生物性能
如:无菌、细菌内毒素等。

