已注册医疗器械产品说明的书变更
已注册医疗器械产品说明书变更审查受理标准依据《医疗器械说明书和标签管理规定》2014年国家食品药品监督管理总局令第6号,第十六条 经食品药品监督管理部门注册审查的医疗器械说明书的内容不得擅自更改。
已注册的医疗器械发生注册变更的,申请人应当在取得变更文件后,依据变更文件自行修改说明书和标签。

说明书的其他内容发生变化的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。审批部门自收到书面告知之日起20个工作日内未发出不予同意通知件的,说明书更改生效。
产品说明的书变更受理条件:
1、广东省药品监督管理局核发的医疗器械注册证,医疗器械产品注册证在有效期内。
2、医疗器械注册证及产品技术要求未发生未发生变更,说明书内容发生变更。
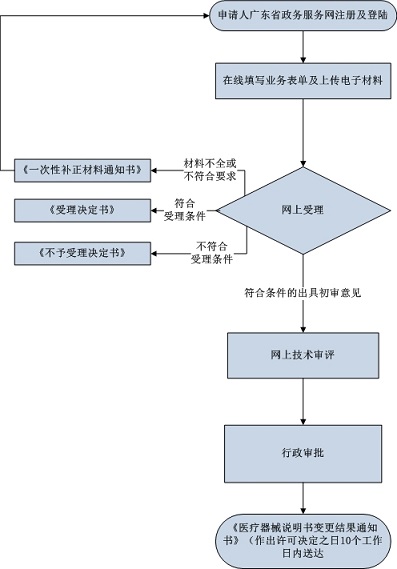
已注册医疗器械产品说明的书变更网上办理流程:
1.受理申请的药品监督管理部门应当自受理之日起5个工作日内将申报资料转交技术审评机构;
2.技术审评:在15个工作日内完成对申请资料技术审评;
3.行政审批:在5个工作日内完成对申请资料,决定是否予以批准。
4.取得办理结果:申请人可以登录广东省药品监督管理局公众网首页查询栏进行进度查询。
医疗器械产品说明的书变更办理步骤:
一、收件
1.申请事项依法不需要取得行政许可的,应当场告知申请人不予受理并出具不予受理通知书;
2.申请事项依法不属于本行政机关职权范围的应当场出具不予受理通知书,并在受理通知书上告知申请人向相关行政机关提出申请;
3.申请人隐瞒有关情况或者提供虚假材料申请的,出具不予受理通知书。
4.不能当场审查不齐全或不符合法定形式的,当场出具收件通知书,五日内审查材料不齐全或不符合法定形式的,出具包含具体补正要求的一次性告知通知书;
5.能当场判断申请材料需要补正的,应当场出具一次性告知通知书。
1.核对申请人是否符合申请条件;
2.依据办事指南中材料清单逐一核对是否齐全;
3.核对每个材料是否涵盖材料要求中涉及的内容和要素。
二、受理
1.能当场受理或通过当场补正达到受理条件的,直接进入受理步骤,当场出具受理通知书;
2.根据一次性告知通知书内容进行补正后达到受理条件的,出具决定受理通知书;
3.收件之日起5个工作日内未收到一次性告知通知书的,从收件之日起即为受理。
1.核对申请人是否符合申请条件;
2.依据办事指南中材料清单逐一核对是否齐全;
3.核对每个材料是否涵盖材料要求中涉及的内容和要素。
三、审查
提出初步意见,转入决定步骤
1.该未开放档案内容是否涉及国家秘密、工作秘密、商业秘密和个人隐私。
2. 该未开放档案是否涉及《各级国家档案馆馆藏档案解密和划分控制使用范围的暂行规定》第七条规定。
四、决定
1.申请符合国家未开放档案利用规定的,准予行政许可。
2.申请不符合国家未开放档案利用规定的,不准予行政许可。
复核审查步骤阶段提出的初步意见。
五、制证
准予行政许可决定书 不准予行政许可决定书
六、送达
1.准予行政许可的颁发《准予行政许可决定书》
2.不予行政许可的颁发《不予行政许可决定书》
医疗器械注册代理医疗器械说明书变更申请材料:
1、资格证明文件
2、医疗器械说明书变更申请表
3、医疗器械说明书变更情况对比说明
4、已核发的产品技术要求复印件、变更前、后医疗器械说明书
5、变化部分对产品安全性、有效性影响的资料
6、所提交资料真实性的自我保证声明

