进口手术刀一类医疗器械备案北京医疗器械注册代办

众所周知,手术刀在《医疗器械分类目录》里是属于一类医疗器械。根据《医疗器械注册管理办法》法规规定如下:
第五条 第一类医疗器械实行备案管理。第二类、第三类医疗器械实行注册管理。
境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料。
境内第二类医疗器械由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。
境内第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。
进口第一类医疗器械备案,备案人向国家食品药品监督管理总局提交备案资料。
进口第二类、第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。
香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。
第十五条 申请人或者备案人应当编制拟注册或者备案医疗器械的产品技术要求。第一类医疗器械的产品技术要求由备案人办理备案时提交食品药品监督管理部门。第二类、第三类医疗器械的产品技术要求由食品药品监督管理部门在批准注册时予以核准。
第十六条 申请第二类、第三类医疗器械注册,应当进行注册检验。医疗器械检验机构应当依据产品技术要求对相关产品进行注册检验。
注册检验样品的生产应当符合医疗器械质量管理体系的相关要求,注册检验合格的方可进行临床试验或者申请注册。
办理第一类医疗器械备案的,备案人可以提交产品自检报告。
第二十二条 办理第一类医疗器械备案,不需进行临床试验。申请第二类、第三类医疗器械注册,应当进行临床试验。
第五十七条 第一类医疗器械生产前,应当办理产品备案。
第七十一条 违反本办法规定,未依法办理第一类医疗器械变更备案或者第二类、第三类医疗器械注册登记事项变更的,按照《医疗器械监督管理条例》有关未备案的情形予以处罚。
第七十七条 第一类医疗器械备案凭证编号的编排方式为:
×1 械备××××2××××3号。
其中:
×1 为备案部门所在地的简称:
进口第一类医疗器械为“国”字;
境内第一类医疗器械为备案部门所在地省、自治区、直辖市简称加所在地设区的市级行政区域的简称(无相应设区的市级行政区域时,仅为省、自治区、直辖市的简称);
××××2 为备案年份;
××××3 为备案流水号。
通过《医疗器械注册管理办法》相关条文相比大家对进口手术刀一类医疗器械备案有一定的了解了。
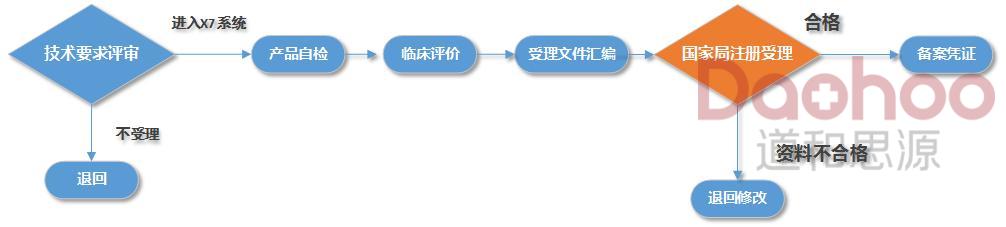
进口手术刀一类医疗器械备案时间及流程图
立项阶段
预算、合同、考虑期,1个月。
受理前资料准备
资料准备时间,视实际发生为准。
无检测、无临床。
受理后
受理后当日即可得到结果。
预算合计
除资料准备时间外,受理后当日即可得到结果。
进口手术刀一类医疗器械备案都需要提供哪些文件
(一)第一类医疗器械备案表
(二)安全风险分析报告
医疗器械应按照YY 0316《医疗器械风险管理对医疗器械的应用》的有关要求编制,主要包括医疗器械预期用途和与安全性有关特征的判定、危害的判定、估计每个危害处境的风险;对每个已判定的危害处境,评价和决定是否需要降低风险;风险控制措施的实施和验证结果,必要时应引用检测和评价性报告;任何一个或多个剩余风险的可接受性评定等,形成风险管理报告。
体外诊断试剂应对产品寿命周期的各个环节,从预期用途、可能的使用错误、与安全性有关的特征、已知和可预见的危害等方面的判定及对患者风险的估计进行风险分析、风险评价及相应的风险控制的基础上,形成风险管理报告。
(三)产品技术要求
产品技术要求应按照《医疗器械产品技术要求编写指导原则》编制。
(四)产品检验报告
产品检验报告应为产品全性能自检报告或委托检验报告,检验的产品应当具有典型性。
(五)临床评价资料
1. 详述产品预期用途,包括产品所提供的功能,并可描述其适用的医疗阶段(如治疗后的监测、康复等),目标用户及其操作该产品应具备的技能/知识/培训;预期与其组合使用的器械。
2. 详述产品预期使用环境,包括该产品预期使用的地点如医院、医疗/临床实验室、救护车、家庭等,以及可能会影响其安全性和有效性的环境条件(如温度、湿度、功率、压力、移动等)。
3. 详述产品适用人群,包括目标患者人群的信息(如成人、儿童或新生儿),患者选择标准的信息,以及使用过程中需要监测的参数、考虑的因素。
4. 详述产品禁忌症,如适用,应明确说明该器械禁止使用的疾病或情况。
5. 已上市同类产品临床使用情况的比对说明。
6. 同类产品不良事件情况说明。
(六)产品说明书及最小销售单元标签设计样稿
医疗器械应符合相应法规规定。进口医疗器械产品应提交境外政府主管部门批准或者认可的说明书原文及其中文译本。
体外诊断试剂产品应按照《体外诊断试剂说明书编写指导原则》的有关要求,并参考有关技术指导原则编写产品说明书。进口体外诊断试剂产品应提交境外政府主管部门批准或者认可的说明书原文及其中文译本。
(七)生产制造信息
对生产过程相关情况的概述。无源医疗器械应明确产品生产加工工艺,注明关键工艺和特殊工艺。有源医疗器械应提供产品生产工艺过程的描述性资料,可采用流程图的形式,是生产过程的概述。体外诊断试剂应概述主要生产工艺,包括:固相载体、显色系统等的描述及确定依据,反应体系包括样本采集及处理、样本要求、样本用量、试剂用量、反应条件、校准方法(如果需要)、质控方法等。
应概述研制、生产场地的实际情况。
(八)证明性文件
1.境内备案人提供:企业营业执照复印件、组织机构代码证复印件。
2.境外备案人提供:
(1)境外备案人企业资格证明文件。
(2)境外备案人注册地或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件。备案人注册地或生产地址所在国家(地区)不把该产品作为医疗器械管理的,备案人需提供相关证明文件,包括备案人注册地或生产地址所在国家(地区)准许该产品合法上市销售的证明文件。如该证明文件为复印件,应经当地公证机关公证。
(3)境外备案人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
(九)符合性声明
1. 声明符合医疗器械备案相关要求;
2. 声明本产品符合第一类医疗器械产品目录或相应体外诊断试剂分类子目录的有关内容;
3. 声明本产品符合现行国家标准、行业标准并提供符合标准的清单;
4. 声明所提交备案资料的真实性。
进口手术刀一类医疗器械备案费用多少
办理境外一类医疗器械产品备案,官方不收取费用。

