北京医疗器械委托生产备案知识大全
基本信息
| 事项编码 | 1111000000002717422112046003000 | 事项类型 | 公共服务 |
| 实施主体 | 北京市药品监督管理局 | 服务对象 | 企业法人 |
| 是否收费 | 不收费 | 权力来源 | 法定本级行使 |
| 办件类型 | 承诺件 | 所属机构 | 北京市药品监督管理局 |
| 办理时间 | 工作日上午09:00-12:00,下午13:30-17:00 { 延时服务时间:每周六9:00-13:00(法定节假日除外,需预约)} | ||
| 办理地点 | 北京市政务服务中心:北京市丰台区西三环南路1号(六里桥西南角)(1-3层综合窗口) | ||
| 办理进程查询途径 | 电话查询:(010)89150280 | ||
| 网上支付 | 否 | 实施主体性质 | 法定机关 |
| 行使层级 | 市级 | 运行系统 | 市级部门 |
| 物流快递 | 是 | 办理方式 | 自办件 |
| 预约办理 | 网上预约,电话预约:(010)89150001 | 办理形式 | 窗口办理、网上办理、快递申请 |
| 中介服务 | 无 | 数量限制 | 无 |
| 通办范围 | 全区 | 联办机构 | 无 |
| 权限划分 | 分条件办理(市区) | 行使内容 | 第二、三类医疗器械委托生产备案在市局办理,第一类医疗器械委托生产备案在区市场监管局办理 |
| 受理条件 | 1.申请材料应完整、清晰、签字并逐份加盖企业公章。使用A4纸打印或复印,装订成册; 2.凡申请材料需提交复印件的,申请人须在复印件上注明日期,加盖企业公章; 3.生产企业提交的《医疗器械委托生产备案表》应有法定代表人签字并加盖企业公章; 4.核对申请材料真实性的自我保证声明应由法定代表人签字并加盖企业公章。 | ||
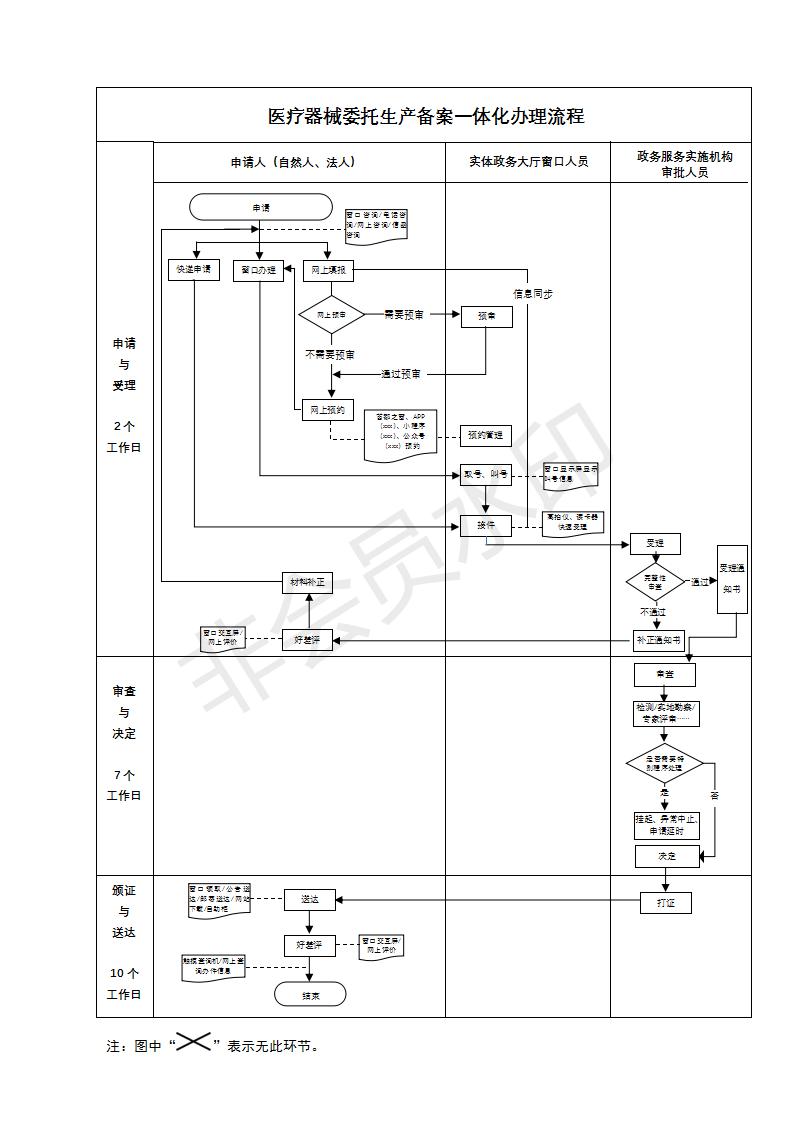
办理流程
| 办理环节 | 办理步骤 | 办理时限 | 审查标准 | 办理结果 | |
|---|---|---|---|---|---|
| 申请受理 | |||||
| 受理 | 2个工作日 |
1.申请材料应完整、清晰、签字并逐份加盖企业公章。使用A4纸打印或复印,装订成册; 2.凡申请材料需提交复印件的,申请人须在复印件上注明日期,加盖企业公章; 3.生产企业提交的《医疗器械委托生产备案表》应有法定代表人签字并加盖企业公章; 4.核对申请材料真实性的自我保证声明应由法定代表人签字并加盖企业公章。 |
符合条件,受理;不符合条件一次性补正或退回 | ||
| 审查与决定 | |||||
| 决定 | 7个工作日 |
(二)审查 标准: 1.委托生产产品应不属于国家食品药品监督管理局公布的禁止委托生产医疗器械目录; 2.《医疗器械委托生产备案表》所填写项目应填写齐全、准确,填写内容应符合以下要求: 所填报内容应与《医疗器械生产许可证》(含《医疗器械生产产品登记表》)或《医疗器械生产企业许可证》相同;“生产范围”应符合第二类、第三类产品管理类别的规定; 3.受托企业的生产范围应当涵盖受托生产的医疗器械; 4.受托企业的生产条件、检测能力、质量管理体系应当与受托生产的医疗器械相适应; |
符合条件,同意;不符合条件退回。 | ||
| 颁证与送达 | |||||
| 制证 | 3个工作日 |
|
|||
| 发证 | 7个工作日 | ||||
| 送达方式: | 窗口领取邮件寄送 | ||||
申请材料
| 序号 | 材料名称 | 材料来源 | 数量要求 | 介质要求 |
表格及 样表下载 |
其他要求 | |
|---|---|---|---|---|---|---|---|
| 原件 | 复印件 | ||||||
| 一、在第二三类产品情况下 | |||||||
| (一) | 《医疗器械委托生产备案表》 | 申请人自备 | 1份 | -- | 表格类;纸质、电子 | 样表下载空表下载 | -- |
| 二、在第二三类产品情况下 | |||||||
| (一) | 委托生产医疗器械的注册证 | 政府部门核发 |
正本1份 (正本原件仅供查验) |
-- | 结果文书类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 三、在第二三类产品情况下 | |||||||
| (一) | 委托方和受托方企业营业执照 | 政府部门核发 |
正本1份 (正本原件仅供查验) |
-- | 结果文书类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 四、在第二三类产品情况下 | |||||||
| (一) | 受托方的《医疗器械生产许可证》(含《医疗器械生产产品登记表》)或《医疗器械生产企业许可证》(第二、三类) | 政府部门核发 |
正本1份 (正本原件仅供查验) |
-- | 结果文书类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 五、在第二三类产品情况下 | |||||||
| (一) | 委托生产合同 | 申请人自备 |
1份 (原件仅供查验) |
-- | 文本类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 六、在第二三类产品情况下 | |||||||
| (一) | 委托生产不属于按照创新医疗器械特别审批程序审批的境内医疗器械的,还应当提交委托方的《医疗器械生产许可证》(含《医疗器械生产产品登记表》)或《医疗器械生产企业许可证》((需现场查验原件,综合窗口工作人员复印1份存档);属于按照创新医疗器械特别审批程序审批的境内医疗器械的,应当提交创新医疗器械特别审批文件资料。 | 政府部门核发 |
正本1份 (正本原件仅供查验) |
正本1份 | 结果文书类;纸质、电子 | -- | -- |
| 七、在第二三类产品情况下 | |||||||
| (一) | 申请材料真实性的自我保证声明,包括企业对材料作出如有虚假承担法律责任的承诺,凡申请企业申报材料时,办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》。 | 申请人自备 | 1份 | -- | 文本类;纸质、电子 | 范本下载 | -- |
| 八、在第一类产品情况下 | |||||||
| (一) | 《医疗器械委托生产备案表》 | 申请人自备 | 1份 | -- | 表格类;纸质、电子 | 样表下载空表下载 | -- |
| 九、在第一类产品情况下 | |||||||
| (一) | 委托生产产品的医疗器械备案凭证 | 政府部门核发 |
正本1份 (正本原件仅供查验) |
-- | 结果文书类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 十、在第一类产品情况下 | |||||||
| (一) | 委托方和受托方企业营业执照 | 政府部门核发 |
正本1份 (正本原件仅供查验) |
-- | 结果文书类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 十一、在第一类产品情况下 | |||||||
| (一) | 受托方第一类医疗器械生产备案凭证 | 政府部门核发 |
正本1份 (正本原件仅供查验) |
-- | 结果文书类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 十二、在第一类产品情况下 | |||||||
| (一) | 委托生产合同 | 申请人自备 |
1份 (原件仅供查验) |
-- | 文本类;纸质、电子 | -- | 需现场查验原件,受理窗口工作人员复印1份存档 |
| 十三、在第一类产品情况下 | |||||||
| (一) | 委托生产不属于按照创新医疗器械特别审批程序审批的境内医疗器械的,还应当提交委托方的第一类医疗器械生产备案凭证(需现场查验原件,综合窗口工作人员复印1份存档);属于按照创新医疗器械特别审批程序审批的境内医疗器械的,应当提交创新医疗器械特别审批文件资料。 | 政府部门核发 |
正本1份 (正本原件仅供查验) |
正本1份 | 结果文书类;纸质、电子 | -- | -- |
| 十四、在第一类产品情况下 | |||||||
| (一) | 申请材料真实性的自我保证声明,包括企业对材料作出如有虚假承担法律责任的承诺,凡申请企业申报材料时,办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》。 | 申请人自备 | 1份 | -- | 文本类;纸质、电子 | 范本下载 | -- |
| 申请材料总要求 | 选择网上提交申报材料的,材料需逐页加盖申报单位电子公章,要求相关人员签名的材料请在相应位置加盖相关人员电子签章。 | ||||||
结果名称及样本
| 医疗器械委托生产备案凭证 | |
| 结果名称 | 医疗器械委托生产备案凭证 |
|---|---|
| 结果样本 | 医疗器械委托生产备案凭证结果样本.docx |
| 有效时间 | 在器械生产许可证有效期内 |
设定依据
| 【行政法规】医疗器械监督管理条例 | |
| 制定机关 | 中华人民共和国国务院 |
|---|---|
| 依据名称 | 医疗器械监督管理条例 |
| 发布号令(文号) | 中华人民共和国国务院令第680号 (2014年第一次修订,2017年第二次修订) |
| 法条(具体规定)内容 |
第二十八条 委托生产医疗器械,由委托方对所委托生产的医疗器械质量负责。受托方应当是符合本条例规定、具备相应生产条件的医疗器械生产企业。委托方应当加强对受托方生产行为的管理,保证其按照法定要求进行生产。 具有高风险的植入性医疗器械不得委托生产,具体目录由国务院食品药品监督管理部门制定、调整并公布。 |
| 【部门规章】医疗器械生产监督管理办法 | |
| 制定机关 | 中华人民共和国国家食品药品监督管理总局 |
|---|---|
| 依据名称 | 医疗器械生产监督管理办法 |
| 发布号令(文号) | 国家食品药品监督管理总局令第7号 |
| 法条(具体规定)内容 | 第三十条 委托生产第二类、第三类医疗器械的,委托方应当向所在地省、自治区、直辖市食品药品监督管理部门办理委托生产备案;委托生产第一类医疗器械的,委托方应当向所在地设区的市级食品药品监督管理部门办理委托生产备案。符合规定条件的,食品药品监督管理部门应当发给医疗器械委托生产备案凭证。 |
收费标准及依据
| 是否收费 | 不收费 |
|---|

