天津医疗器械委托生产备案
基本信息
| 事项名称 | 医疗器械委托生产备案 | 事项类型 | 其他行政权力 |
|---|---|---|---|
| 办理部门 | 天津市药品监督管理局 | 主管部门 | 天津市药品监督管理局 |
| 法定办理时限 | 20个工作日查看说明 | 承诺办理时限 | 1个工作日查看说明 |
| 是否涉及特殊环节 | 无; | 受理时间 | 周一至周五(工作日)上午8:30-12:00,下午13:30-18:00。 |
| 是否马上办 | 否 | 业务主管部门 | 天津市药品监督管理局 |
| 办理部门 | 天津市药品监督管理局 | 实施编码 | 11120000MB1662153N3121031024000 |
| 咨询电话 |
电话:23520871 |
监督电话 | 投诉电话:83555385 地址:南开区红旗南路237号 |
| 办理地点 |
企业通过“天津市医疗器械企业服务平台”提交申请。办理地点:南开区红旗南路237号A座518室 |
通办范围 | 跨区 |
| 有效期限 | 不应超过申报资料中企业提交的各类证件***先到达的截止日期 | 适用范围 | 全国 |
| 是否预约审批 | 否 | 预约审批电话 | -- |
| 到现场办事次数 | 0 | 权力来源 | 法定机关 |
| 是否网上办事项 | 是 | 是否就近办事项 | 是 |
| 是否一次办事项 | 是 | 是否无人审批事项 | 否 |
| 是否承诺审批事项 | 是 | 是否以函代办事项 | 否 |
| 是否同城通办事项 | 是 | 办件公示 | 否 |
| 监管细则 | 30医疗器械委托生产备案事项监管细则.docx | ||
| 审批收费 | |||
| 是否收费 | 否 | ||
| 收费标准 | 不涉及 | ||
| 实施权限 | |||
| 市级权限 | 本市行政区域内的申请,由天津市市场监管委(药品监督管理局)办理。 | ||
| 自贸试验区权限 | 本行政区域内,不应有此权限。 | ||
| 滨海新区权限 | 本行政区域内,不应有此权限。 | ||
| 市区权限 | 本行政区域内,不应有此权限。 | ||
| 郊区权限 | 本行政区域内,不应有此权限。 | ||
办理形式
| 运行系统 | 县级 | 系统名称 | 天津市医疗器械企业服务平台 |
|---|---|---|---|
| 是否支持网上支付 | 否 | 是否支持物流快递 | 否 |
| 预约途径 | 无 | 办理类型 | 即办件 |
| 是否数量限制 | 否 | ||
| 是否联办 | 否 | 联办部门 | -- |
申请条件
申请条件包括:
a) 医疗器械委托生产的委托方应当是委托生产医疗器械的境内注册人或者备案人。其中,委托生产不属于按照创新医疗器械特别审批程序审批的境内医疗器械的,委托方应当取得委托生产医疗器械的生产许可或者办理第一类医疗器械生产备案。
b) 医疗器械委托生产的受托方应当是取得受托生产医疗器械相应生产范围的生产许可或者办理第一类医疗器械生产备案的境内生产企业。受托方对受托生产医疗器械的质量负相应责任。
c) 委托方应当向受托方提供委托生产医疗器械的质量管理体系文件和经注册或者备案的产品技术要求,对受托方的生产条件、技术水平和质量管理能力进行评估,确认受托方具有受托生产的条件和能力,并对生产过程和质量控制进行指导和监督。
d) 受托方应当按照医疗器械生产质量管理规范、强制性标准、产品技术要求和委托生产合同组织生产,并保存所有受托生产文件和记录。
e) 委托方和受托方应当签署委托生产合同,明确双方的权利、义务和责任。
办理依据
| 序列 | 法律名称 | 条数 | 附件 |
| 1 | 《医疗器械生产监督管理办法》(国家食品药品监督管理总局第7号令,2017年修正)第26条、第30条 | 第26条、第30条 | 《医疗器械生产监督管理办法》(国家食品药品监督管理总局第7号令,2017年修正)第26条、第30条 |
其他依据
申请材料
| 序号 | 材料名称 | 材料形式 | 材料要求 | 材料下载 | 其他信息 |
| 1 | 医疗器械委托生产备案表 |
原件:1 复印件:0 纸质 |
主审材料 材料准备要点 其他要求 |
医疗器械委托生产备案表空白表.docx 医疗器械委托生产备案表及填写说明.docx |
材料来源 |
| 2 | 委托生产合同 |
原件:0 复印件:1 纸质 |
主审材料 材料准备要点 其他要求 |
材料来源 |
|
| 3 | 受托方的《医疗器械生产许可证》或者第一类医疗器械生产备案凭证 |
原件:0 复印件:1 纸质 |
主审材料 材料准备要点 其他要求 |
材料来源 |
|
| 4 | 委托方和受托方企业营业执照 |
原件:0 复印件:1 电子版 |
可容缺材料 材料准备要点 其他要求 |
材料来源 |
|
| 5 | 委托生产医疗器械的注册证或者备案凭证 |
原件:0 复印件:1 纸质 |
主审材料 材料准备要点 其他要求 |
材料来源 |
收费项目信息
不收费
中介服务
无
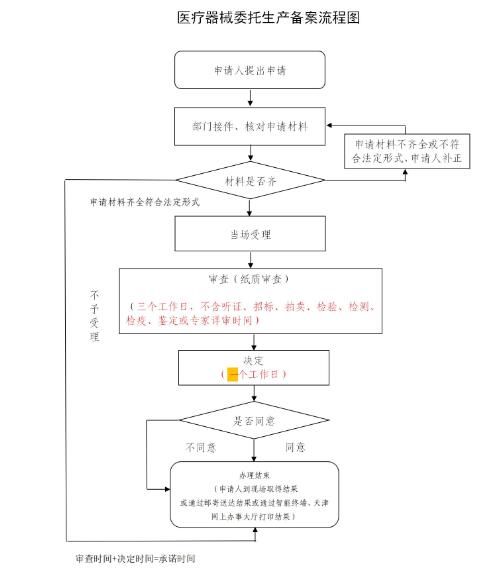
办理流程
| 序号 | 流程 | 详细内容 | ||
| 1 | 决定 |
| 环节名称 | 决定 |
| 审查标准 | |
| 结果 | 办理工作人员应根据法律、法规、规章和审查意见,并按照下列情况分别作出处理: a)申请人提交的申请材料齐全、符合法定形式的,应在承诺时限内办理完成,并签发相应证书; b)网上办理事项申请材料齐全、符合法定形式的,签发相应证书; c)通过智能终端进行申请办理的,当场出具有关决定; d)依法作出不予办理的,应当说明理由,并告知申请人享有依法申请行政复议或者提起行政诉讼的权利。 |
| 2 | 审查 |
| 环节名称 | 纸质审查 |
| 审查标准 | 纸质审查主要审查以下内容: c)格式正确; d)内容合法; e)按照法律法规规定查验原件与复印件的一致性。 |
| 结果 | 通过/不予通过 |
| 3 | 受理 |
| 环节名称 | 形式审查 |
| 审查标准 | 委托生产医疗器械的注册证或者备案凭证 应主要审查:加盖申请企业公章; 委托方和受托方企业营业执照 应主要审查:加盖申请企业公章; 受托方的《医疗器械生产许可证》或者第一类医疗器械生产备案凭证 应主要审查:加盖申请企业公章; 委托生产合同 应主要审查:加盖申请企业公章; 医疗器械委托生产备案表 应主要审查:内容是否完整准确,加盖申请企业公章; |
| 结果 | 接件人员根据下列情况分别作出处理: a)申请材料齐全、符合法定形式,或者申请人按照办理部门的要求提交全部补正申请材料的,应当在“天津市政务服务运行与监察考核系统”上,受理该申请,并出具《受理告知书》; b)申请事项依法不需要办理的,应当即时告知申请人不受理,并出具《不予受理告知书》。 |
流程图
办理结果
| 序列 | 结果名称 | 结果样板 |
| 1 | 医疗器械委托生产备案凭证 |
医疗器械委托生产备案凭证 |

