应用纳米材料的医疗器械安全性和有效性评价指导原则第一部分:体系框架
一、背景
现有的医疗器械中应用的纳米材料包括添加到医疗器械中的游离态纳米材料,利用纳米材料特性增加生物学活性(如医用纳米羟基磷灰石/聚酰胺66复合骨充填材料)或者预防感染(如纳米银创伤贴)的固化纳米材料以及利用纳米技术设计制备成纳米结构的医疗器械(如口腔种植体材料表面纳米化处理)等。此外,即使医疗器械本身不含有纳米材料,其使用/植入过程也有可能导致纳米颗粒的产生。
根据国家标准(GB/T 30544.1),纳米材料是指任一外部维度、内部或表面结构处于纳米尺度的材料,而纳米尺度是指1~100 nm之间的尺寸范围,该尺寸范围通常,但非专有地表现出不能由较大尺寸外推得到的特性,对于这些特性来说,1-100 nm的上、下限值是近似的。纳米材料独特的物理、化学和生物学性质为医疗器械获得突破性发展提供了新的机遇,同时也蕴含潜在的临床应用风险。
本指导原则为申请人/监管人员提供关于应用纳米材料的医疗器械安全性和有效性评价相关方面的信息。
本指导原则是对应用纳米材料医疗器械的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充分说明和细化。申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述理由及相应的科学依据。
本指导原则是对申请人和审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围
本指导原则适用于与人体直接或间接接触,由纳米材料组成或包含纳米材料的医疗器械的安全性和有效性评价。
不适用于:
- 应用纳米材料的体外诊断(In Vitro Diagnosis,IVD)产品,但在考虑IVD产品有效性时,可参考相关内容;
- 应用纳米材料的赋能技术;
- 应用纳米材料的药品;
- 应用纳米材料的医疗器械在制造和废弃过程中造成的职业和环境风险。
三、一般原则
(一)应用纳米材料医疗器械的分类
目前现有或者正在处于研发阶段的应用纳米材料的医疗器械,按照GB/T 16886.1进行分类。对于所有类型的医疗器械,纳米材料的潜在暴露均应纳入考虑。
(二)风险评估
纳米材料的特性为医疗器械获得突破性发展提供了新机遇,同时也存在潜在的不确定风险,在设计、临床前测试、临床评价和设计变更等阶段,注册申请人可以根据GB/T 16886.1、YY/T 0316和《医疗器械产品受益-风险评估注册技术审查指导原则》等中规定的风险因素,对应用纳米材料的医疗器械进行风险评估。应用纳米材料医疗器械的风险因素主要包括纳米材料从器械释放的可能性、暴露剂量、暴露途径、接触部位和暴露时间。
(三)安全性评价
生物学评价是应用纳米材料医疗器械安全性评价的重要内容。GB/T 16886.1规定了应当根据器械类型、接触途径和接触时间来进行生物学风险评估的程序框架,该程序框架通常也适用于应用纳米材料的医疗器械。GB/T 16886系列标准的后续部分描述了详细的试验方案和评价策略。
当前ISO TC 194“医疗器械生物相容性评价技术委员会”已颁布了医疗器械生物学评价第22部分:纳米材料指南,纳米材料生物学评价可参考ISO/TR 10993-22。目前,已发布并实施的三项推荐性标准:YY/T 0993、YY/T 1295和YY/T 1532,这些标准为应用纳米材料的医疗器械生物学评价提供了专属方法。
由于纳米材料的比表面积等因素不同,纳米材料表现出不同的理化性质,因此,生物体暴露于纳米材料之后,可能表现出与常规材料不同的生物学反应。申请人应针对医疗器械的结构特征、预期用途、与人体的接触途径、所含纳米材料的种类和形态等因素,通过设计一系列试验来确认测试系统的适用性,从而建立起适合所申报产品特点的生物学评价试验方案。应用纳米材料医疗器械的安全性评价流程和路径见图1。
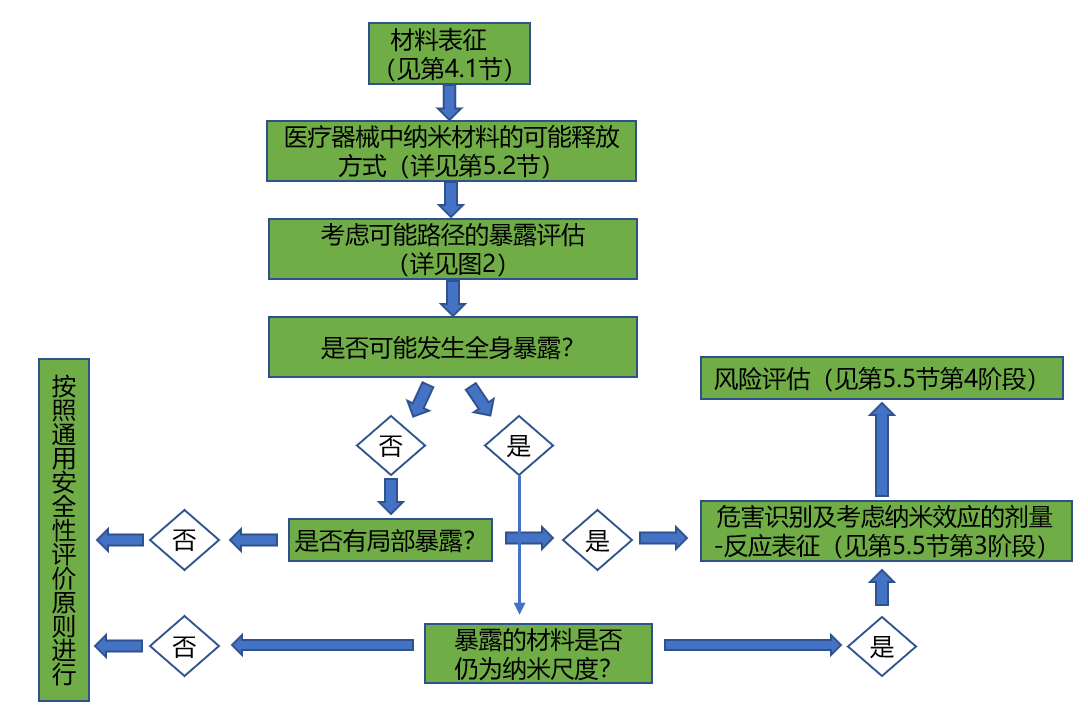
图1 作为应用纳米材料医疗器械风险评估组成部分的安全性评价流程图
(四)有效性评价
应用纳米材料的医疗器械有效性评价方法可包括台架试验、体外测试、计算机模拟、动物实验和临床试验。申请人应阐明在产品中使用纳米材料/纳米技术的必要性,以及与不采用纳米材料的已上市同品种医疗器械明显优势。如有可能,临床试验建议采用优效性试验。
应用纳米材料的医疗器械开展动物实验评价,可以根据医疗器械动物实验研究技术审查指导原则第一部分和第二部分的要求进行。临床评价应按照《医疗器械监督管理条例》《医疗器械注册管理办法》《医疗器械临床试验质量管理规范》和《医疗器械临床评价技术指导原则》等要求进行。
由于纳米技术是正在快速发展的新兴领域,应用纳米材料的医疗器械在进行风险评估时,可能无法与已上市的同品种医疗器械进行等同性比较,需要通过适宜的动物模型和临床试验来评价其有效性。申请人宜提出明确的试验目的(即拟解决的问题),并根据试验目的由具有相应专业知识和实践经验的人员来制定科学、合理的研究方案。
(五)安全性和有效性评价体系框架
根据《医疗器械安全和性能的基本原则》,医疗器械应是安全的并且能够实现其预期性能,其设计和生产应确保器械在预期使用条件下达到预期目的,与患者受益相比,其风险应是可接受的,且不会损害医疗环境、患者安全、使用者及他人的安全和健康。
本系列指导原则将在充分吸收***新科研成果的基础上,分别对应用纳米材料的医疗器械理化表征、生物学评价、动物实验评价、体外替代测试/计算机模拟研究及临床评价进行分析,并给出建议。由于医疗器械种类众多,其人体接触/暴露途径也存在很大差异,具体到某一医疗器械,并非上述所有评价方法都是必要的。
四、理化表征
(一)一般原则
医疗器械的材料表征包括化学、物理、形态学和表面等性质的表征(GB/T 16886.18和GB/T 16886.19),纳米材料表现出独特的性质取决于它们的大小、结构和表面性质等不同于常规材料。因此,参与组成器械的纳米材料的理化性质表征是完成生物学评价的重要一步,可以指导应用纳米材料医疗器械生物学评价试验方案的制定,也对医疗器械中新的纳米材料进行有效筛选给出建设性意见。
ISO/TR 13014列出了以下毒理学试验中需要表征的工程化的纳米材料的特性:化学成分、纯度、尺寸和尺寸分布、聚集和团聚状态、形状、表面积、表面化学、表面电荷、溶解度和分散度等。
附加属性的表征可以根据医疗器械的设计、预期用途和磨损特性来表示。如结晶、孔隙度、氧化还原电位、(光)催化、自由基的形成潜力和辛醇/水系数(未必适用于固体材料)等。
除了上述理化表征,表面具有纳米结构的医疗器械可能需要从形态学上进行表征。对于表面结构的有效表征所需测量的参数取决于特定的应用。如对应用纳米多孔材料的医疗器械的表征包含但不限于以下信息:孔隙或空隙的尺寸和结构、密度和分布等。
(二)表征参数与方法
ISO/TR 13014提供了与纳米材料相关的生物学评价参数的详细信息和每个参数进行定量和/或定性分析的方法。随着对纳米材料的不断研究和探索,其表征方法也将不断改进优化,故以上内容应根据需要进行动态调整。
结合几种方法可以同时研究颗粒大小、形状、结构、组成成分和表面性质。单一的表征方法可能无法提供准确的评价参数(例如粒径分布、表面配体和表面电荷等),建议使用微观和宏观多种方法用于一个特定理化参数的表征。但需要注意,可能对特定属性使用不同方法所获得的结果不能直接比较,并且目前几乎没有统一方法对纳米材料进行理化评价以辅助形成可靠的试验方案。申请人宜在医疗器械中纳米材料的类型、形式以及医疗器械预期用途的基础上选择表征的方法。
由于纳米材料的表征往往是科学和技术上的挑战,因此,申请人宜考虑实验室的质量保证体系和***优方案。纳米材料理化表征手段的选择、表征结果和纳米材料特性的解释分析应该由经过培训且有经验的专业人员进行。在分析过程中,宜谨慎考虑样品制备以确保所获得的数据来自该器械中有代表性的材料。如有可能,申请人宜在理化表征中采用可获得的适当的参照材料,以便对分析仪器设备和试验方法进行校正和检验。表征过程的各个环节应仔细记录,以确保结果的可追溯性和可重复性。若有必要,所用方法应进行方法学验证被证实能恰当用于纳米材料的研究。有关应用纳米材料的医疗器械理化性质表征的具体内容,将在本系列指导原则第二部分:应用纳米材料的医疗器械理化表征指导原则中给出。
五、生物学评价
本指导原则仅给出应用纳米材料医疗器械生物学评价的概述。有关具体内容,将在本系列指导原则第三部分:应用纳米材料的医疗器械生物学评价指导原则中给出。
相比于常规材料,纳米材料在样品制备时会有溶解性和分散性的区别,因此可能需要考虑纳米材料在样品制备时的特殊性;由于纳米材料被认为可能穿越所有的保护屏障,包括血脑屏障和胎盘屏障等,因此可能需要考虑纳米材料的全身毒性,特别是中枢神经毒性和生殖毒性;“纳米分子冠”的形成,可能会影响其生物响应、动力学、蓄积和毒性等生理效应;有些纳米材料具有类佐剂特性,可能会对免疫系统产生影响,需要关注免疫毒性;血液中纳米材料暴露的时间间隔不同可能改变其毒代动力学特征。因此,应用纳米材料的医疗器械生物学评价内容,在兼顾常规器械评价内容的基础上,重点考虑与纳米材料有关的其他问题,如样品制备,吸收、分布、代谢和排泄/清除(ADME)、全身毒性、中枢神经毒性和免疫毒性等。
(一)样品制备
样品制备是对医疗器械***终产品及其制造过程中使用的材料进行表征和/或生物学试验时的一个关键的多步骤过程,包括对器械有代表性取样、浸提液制备,制备的试验材料的贮存和稳定性检测等,应重点关注应用纳米材料医疗器械的***终产品在样品制备不同阶段的理化性质。样品制备具体内容详见GB/T16886.12。
与常规材料相比较,纳米材料样品制备时应该考虑的因素包括表面特性增加了其反应性,溶解性和分散性的区别,聚集物或团聚物的形成和微量杂质的污染(微量杂质可能对纳米材料理化特性和毒理学特性具有潜在的影响)等。另外,纳米材料有吸附到容器表面的可能性。由重力引起的扩散和重力沉降也会影响纳米材料(当发生团聚或聚集、或纳米材料由致密物质组成等)到细胞的输送率。纳米毒理学的剂量单位可能不是传统的质量浓度,而是纳米颗粒数量或总表面积。
针对这些问题,有必要针对应用纳米材料的医疗器械制定可靠的样品制备方案。
在样品制备时,需要仔细分析来确定一个特殊的纳米材料在规定的实验条件下是否完全分散、和/或部分溶解(如一些金属)还是完全溶解,因为微溶或不溶的纳米材料可能以颗粒的形式分散存在于实验体系中。分散可能引起一种不同于从化学成分预测的分子、离子或元素毒性的反应;而可溶性的纳米材料可能出现与相同分子或元素组成的常规材料相似的反应。
纳米材料的分散性受纳米材料之间和/或与其所处环境相互作用的影响,分散的纳米材料不一定仅以原形存在,也可能以聚集体或团聚体的形式存在;纳米材料的粉末和气溶胶形式通过表面电荷或空间效应则变得不稳定。因此,试验样品稳定性是纳米材料生物学评价中获得准确、可靠的试验结果的关键因素之一。
电解质浓度、pH范围、离子强度或分子成分(如血清蛋白分子等)对浸提液制备有显著影响。因此,生物学评价试验中应用的分散条件应尽可能与生理条件一致。
在应用纳米材料医疗器械的成品或原材料的表征、动物实验或体外试验时,需要进行样品制备。制备的具体方法可能因接触途径和剂量选择的不同而有差异。在试验样品制备和接触方式的记录或报告内容中至少应包含以下内容:
——试验材料的鉴定、贮存和稳定性,包括批与批之间的差异性;
——浸提介质的化学组成;
——合适的剂量单位选择;
——原料分散剂制备的样品在给予动物(和/或细胞、器官、组织)之前的表征。
作为一般原则,样品制备的细节和所选用方法的基本原理应当详细记录。
(二)医疗器械中纳米材料的释放
一般来说,纳米材料从医疗器械中释放的***大潜力与器械本身设计相关:
——预期的纳米材料释放;
——由游离纳米材料组成和/或含游离纳米材料,例如用于热疗的氧化铁纳米颗粒、用于伤口敷料的纳米银和骨填料中的纳米材料等。
某些器械可能涉及多种释放途径,宜综合考虑释放特征进行分析。
1.脱落
当纳米材料作为医疗器械涂层时,应考虑脱落的风险,如作为伤口敷料的纳米银等。
2.降解释放
含有或者不含纳米材料的医疗器械,通过水解反应、催化反应或磨损等降解方式,可能会引起纳米材料的释放。当纳米材料作为涂层或包埋在可降解基质中时,可降解材料的生物分解会导致纳米材料的释放,不含纳米材料的医疗器械通过降解可能导致纳米颗粒物的产生。
当纳米材料可能通过器械的降解产生时,可参考GB/T16886.9对医疗器械潜在降解产物进行定性和定量研究。根据GB/T16886.9附件A关于包含的对降解研究考虑的需要,如果需要,降解研究应考虑:
a) 器械被设计为可吸收的;或
b) 器械的预期植入时间超过三十天,或
c) 该材料(多个)系统的相关信息提示其与机体接触的过程中可释放有毒物质。
GB/T16886.13、14和15分别包含了聚合物、陶瓷、金属以及合金降解的一般性原则。
伴有离子释放的腐蚀也可能导致纳米材料的释放。对于某些纳米材料,已知释放的离子可以形成新的纳米材料。
3.磨损释放
来自于器械降解、磨损或加工处理过程中,以及在生产过程中未使用纳米材料,但医疗器械(或部件)在临床使用过程中通过降解、磨损或在原位处理过程中(如医疗器械原位研磨、抛光等)产生纳米材料。许多医疗器械都可能随着长时间使用导致磨损和纳米结构成分(如颗粒等)释放至周围环境。因此,如果下述条件适用时,应合理论述由磨损释放的纳米材料:
a) 该器械是纳米材料,或
b) 该器械有纳米材料涂层,或
c) 该器械中,其正常使用的情况下,与生物组织产生摩擦或其组件或与骨填充物或复合物之间产生摩擦,或者可能
d) 生产过程中的残留物可能包括纳米材料。
应当注意的是,尽管在制造某些医疗器械时不会使用纳米材料,但由于磨损可致该医疗器械(例如植入物和牙科填充材料)产生纳米材料。
4.原位处理释放
无论医疗器械是否含有纳米材料,该器械进行原位处理时,例如在牙科处理时(例如抛光,研磨)也可能产生纳米材料。
因此,应在类似于预定用途的生理条件下对可能释放的纳米材料进行全面的鉴定和表征。且应在生理环境下,对纳米材料的释放动力学、数量、迁移和生物蓄积性进行评估。
在情形3和4,即磨损释放和原位处理释放的情况下,医疗器械本身不适用本指导原则。但在考虑此类医疗器械的不良事件和使用风险时,可参考本指导原则适用部分对可能由产生的纳米材料进行研究分析。
(三)毒代动力学
1.一般原则
如果从医疗器械中释放的纳米材料可以被吸收(Absorption)、分布(Distribution)、代谢(Metabolism)和/或排泄(Excretion),即需要进行毒代动力学(ADME)的研究。纳米材料的毒代动力学研究可指导生物学评价试验设计及结果解读,应被视为应用纳米材料医疗器械风险评估的一部分。GB/T 16886.16给出了关于如何开展毒代动力学研究的框架。对于应用纳米材料医疗器械的毒代动力学研究,还需要考虑纳米材料的理化性质、表面特性(如化学和电荷)、接触途径、剂量效应、动物模型、研究周期、浸提方法和分析技术/手段等因素。
在进行毒代动力学研究时,申请人需说明影响该研究设计、试验结果和结果解读的因素。
2.毒代动力学的影响因素
a)理化性质
纳米材料的尺寸和尺寸分布、形状、表面电荷、聚集和团聚、亲水性以及表面结构等特性可以影响ADME。然而到目前为止,哪一特性作为***关键的参数影响ADME仍不明确,因此要在对纳米材料进行充分表征的基础上,开展毒代动力学研究。
b)生物分子吸附
生物环境中的纳米材料在其表面经受快速的蛋白质、脂质等生物分子吸附,形成纳米材料-生物分子复合物(纳米生物分子冠)。“纳米生物分子冠”改变及赋予纳米材料不同于原始状态的生物学特性,影响生物响应、动力学、蓄积和毒性等生理效应。采用与生理环境相似的模拟液将有助于评价生理条件下纳米材料表面生物分子吸附特征,并对纳米材料的生物转化进行评价。
c)接触途径
接触途径能够影响纳米材料的表面特性和生物分布。吸附在纳米材料表面的分子可以进一步影响被释放纳米材料的动力学。因此,由于不同的接触途径,纳米材料可以被不同的生物分子覆盖,从而影响其毒代动力学特征和毒性。
d)剂量效应
纳米材料的暴露大于机体清除时,则会导致在体内蓄积,甚至导致组织清除率饱和以及毒代动力学特征的改变。如高剂量和/或重复接触的纳米材料进入血液(例如超出了肝和脾吞噬细胞的吞噬能力),可能造成纳米材料在单核巨噬细胞系统( mononuclear phagocyte system,MPS)以及其他组织的长期蓄积,并有可能再次分配进入血液。因此,血液中纳米材料的暴露可能不足以评价纳米材料的毒性特征,还应密切关注不同时间点的组织分布和清除情况。另外,血液中纳米材料暴露的时间间隔不同也可能影响其毒代动力学特征。
因此,应关注不同的接触剂量及接触频率对纳米材料的毒代动力学特征和毒性的影响。
e)物种和性别
由于物种和性别之间存在生理学和解剖学的差异,可能会导致纳米材料毒代动力学特征的不同,如雌性比雄性大鼠更容易发生纳米银及其衍生物的肾脏蓄积。因此,毒代动力学和全身毒性研究时应选择合适的动物种属和性别。
f)测量技术
在测量组织和器官中的纳米材料时,由于生物背景比较复杂,检测效能和灵敏度可能会进一步降低。因此,纳米材料或其组成元素的检测方法需要排除生物背景的干扰。
纳米材料既可以用放射性或荧光标记方法标记,也可通过分析其元素组成来确定。当选择标记技术时,需考虑标记物可能从纳米材料中释放和/或标记物可能改变纳米材料与环境间的相互作用,从而影响其毒代动力学特征。
若使用低检测限的方法不适用于检测组织和器官中极低水平的纳米材料时,可考虑对测试样品进行额外的处理以便于增加该技术的灵敏性。如果通过增加剂量或重复给药来保证在组织/器官中纳米材料的可检测性,则可能使单核巨噬细胞系统摄取纳米材料达到饱和,从而改变纳米材料的ADME。
(四)生物学评价
1.细胞毒性
建议基于体外试验和已有数据与预期暴露情况相关性的评估,参照GB/T 16886.5和YY/T 0993来开展试验。
在评估应用纳米材料医疗器械的细胞毒性时,应考虑纳米材料特性、细胞敏感性、特定受体或反应机制等因素。可根据预期使用部位和可能接触的细胞类型,选择相似的非吞噬性细胞系和/或吞噬性细胞系进行试验。纳米材料本身的特性可能干扰试验体系,如纳米材料可能会吸附培养基中的蛋白质和/或与某些荧光染料发生反应等,需要评估纳米材料对试验体系是否有影响。另外,细胞毒性试验需要确定纳米材料适宜的剂量单位,如质量、表面积、质量体积浓度或纳米颗粒的数量等。
2.刺激性和致敏性
GB/T 16886.10描述了医疗器械及其组成材料产生刺激和皮肤致敏可能性的评估过程。
(1)刺激性
根据GB/T 16886.1标准,应考虑刺激性试验,在适宜的模型中使用适当的应用部位如皮肤、眼睛和粘膜等,评估医疗器械、材料和/或它们的浸提物的潜在刺激性。此要求也适用于应用纳米材料的医疗器械。
(2)致敏性
纳米材料本身可能会导致致敏,纳米材料与蛋白质相互作用导致纳米材料/蛋白质复合物形成,其作为一种继发效应也可能会导致致敏。由于皮肤的屏障功能,纳米材料可能到达致敏的靶细胞和器官、皮肤树突状细胞和引流淋巴结受限。因此,使用GB/T 16886.10中描述的方法评价纳米材料医疗器械的致敏性时,需要关注方法的适用性。
3.全身毒性
由于纳米材料被认为可能穿越所有的生理屏障,包括血脑屏障和胎盘屏障等。因此,需要根据***初的暴露方式、人体的接触部位等,分析是否有游离纳米材料进入体内的可能性。如果有,则需要考虑纳米材料的全身毒性,特别是神经毒性和免疫毒性。
(1)全身毒性
当评估纳米材料的全身毒性时,溶解度是需要考虑的一个关键参数。水溶性纳米材料在接触组织或体液时会溶解,可能表现出与常规材料相似的毒性反应,但难溶的纳米材料可能使机体的清除能力和防御机制很快被耗尽,从而导致体内蓄积和全身不良反应。
经评估应用纳米材料的医疗器械具有全身毒性风险时,需要进行全身毒性评价。应参考GB/T 16886.11所述,基于临床使用情况、纳米材料的特性、暴露时间和毒代动力学研究,来评估应用纳米材料医疗器械的全身毒性。
因为纳米材料可能分布于全身,应在具体问题具体分析的基础上,考虑预期用于组织病理学分析的组织/器官选择,特别注意单核巨噬细胞系统(特别是肝、脾)、肾、脑、骨髓、淋巴结等。另外,剂量单位、剂量大小、接触频率和接触时间也可影响全身毒性试验结果。
(2)神经毒性
纳米材料可以直接或间接与神经系统接触,如:纳米材料可能通过鼻黏膜-嗅球-感觉神经到达中枢神经,另外,纳米材料还可能透过血脑屏障,进入中枢神经系统。由于神经细胞清除纳米材料的速度非常缓慢(溶解和清除),可能导致纳米材料在脑内蓄积产生毒性。因此,应用纳米材料的医疗器械应关注纳米材料与神经系统接触的可能性、分布特征、蓄积性、与神经细胞的反应活性及对中枢神经系统功能的影响。
经评估应用纳米材料的医疗器械具有神经毒性风险时,需要进行神经毒性评价。神经毒性评价可以分层次地开展体外和体内神经毒性试验。体外神经毒性试验主要涉及两种类型,即活力测定和功能测定。体内动物实验可结合亚慢、长期毒性研究或功能组合观察试验(FOB),通过一系列指标评价纳米材料的神经毒性,例如神经系统组织病理学检查、神经元及胶质细胞毒性评价(特异性免疫染色)和动物中枢神经系统功能的改变等,如有必要,可增加神经递质、神经元结构及炎症因子等指标。
(3)免疫毒性
免疫系统暴露于纳米材料可能导致炎症或过敏性/自身免疫反应等。其程度和反应类型取决于纳米材料的特性、类佐剂效应、炎性作用以及其激活补体系统的能力、免疫应答后可被激发或抑制等方面因素。
纳米材料进入全身循环系统后,主要终结于单核巨噬细胞系统。因此,纳米材料的免疫毒性可能需要特殊考虑。GB/T16886.20描述了免疫毒性试验总体考虑。如果需要评估免疫毒性,可伴随重复接触毒性试验进行初步评估,通过此试验可检测到的免疫抑制和/或免疫刺激的一般指征。
如果需要进一步评估免疫毒性,可采用体外模型进行。体外模型提供了可靠的研究免疫细胞功能的方法,可评估免疫细胞的吞噬功能、趋化性、炎性因子和一氧化氮产生等指标。也可在特殊的免疫细胞中,通过信号通路评价纳米材料对免疫细胞功能的影响,如核因子kappaB通路。
4.热原
由于纳米材料具有较大的比表面积,其表面极易吸附微生物及其内毒素(LPS)等,从而增加了热原反应风险。可参考GB/T16886-11及YY/T 1295给出的试验方法进行应用纳米材料的医疗器械内毒素检测。在评价热原反应过程中,要考虑纳米材料是否对试验系统有影响。其它可参考的信息包括:单核细胞激活试验(MAT)及相关美国药典和标准(USP85,USP151和ANSI/AAMI ST72)中关于热原反应评价方法。
除内毒素介导的致热性外,也需考虑非内毒素介导的致热性。应用纳米材料的医疗器械介导的热原反应作为生物学评价的一部分,具体方法参照GB/T16886.11和中国药典。
5.植入
GB/T16886.6中描述了医疗器械体内植入试验。根据医疗器械类型可以考虑不同植入部位(例如皮下、肌内、颅内等)。对于游离纳米材料,可考虑直接注射到相应的组织。
如果医疗器械中纳米材料有释放的可能性时,应当特别注意纳米材料向局部引流淋巴结的迁移。
当采用原位植入试验评估潜在的全身毒性时,应考虑GB/T16886.6和GB/T16886.11的要求。
6.血液相容性
应对直接或间接接触血液的应用纳米材料的医疗器械进行血液相容性评价。此外,即使对非血液接触的器械,如果毒代动力学研究显示来自医疗器械的游离纳米材料可能进入全身血液循环时,也应进行血液相容性评估。
可参考GB/T16886.4和YY/T 1532-2017中描述的评估策略和常规方法评价应用纳米材料的医疗器械血液相容性。根据被检测的初始过程或系统将血液相互作用分为几类:血液学、血栓形成、凝血、血小板活化和补体系统激活。
可以合理地直接使用GB/T16886.4中描述的常规方法对表面具有纳米材料(非游离状态)的医疗器械进行评价。由于纳米材料具有**的比表面积,血液中大量的血清蛋白可轻易地吸附于游离纳米材料,改变其进入血液后的级联反应,因此,游离纳米材料的血液相容性评价可能**有挑战性。另外,纳米材料与血液接触后潜在的聚集/团聚也会改变与血小板、凝血因子和血管内皮细胞的相互作用。
以上因素可能对体外试验产生干扰,在得出关于游离纳米材料血液相容性任何结论前应特别注意所使用方法的重现性、可靠性和灵敏度。若体外试验不足以评价纳米材料的血液相容性时,可考虑采用体内试验,比如通过检测血液学、血生化相关指标(如红细胞计数、血红蛋白、总胆红素、直接/间接胆红素等)来综合评价纳米材料的血液相容性。
纳米材料和补体系统之间的相互作用受纳米材料的尺寸、形态和表面特性等因素影响。血液中纳米材料导致补体系统激活的异常增强可能诱发显著性炎症反应及急性过敏反应。因此,在存在全身暴露的情况时,补体激活应作为应用纳米材料医疗器械风险评估的一部分。
7.遗传毒性、致癌性和生殖毒性
GB/T 16886.3适用于已识别或未知的可能有遗传毒性、致癌性和生殖毒性的医疗器械或组件的评价。与常规器械相比,应用纳米材料的医疗器械可能具有不同的遗传毒性、致癌性和生殖毒性。
(1)遗传毒性
纳米材料可以透过细胞膜,进入细胞核并与遗传物质(DNA或染色体)相互作用。也可能通过氧化应激或炎症等作用机制诱发染色体或DNA断裂。因此,纳米材料的遗传毒性风险可能是直接或间接机制的结果,可能表现为基因突变和/或染色体损伤。
遗传毒性评价的***终目的是预测供试品潜在的致癌性或其它可遗传的危害。对遗传毒性试验结果进行评价时,应结合纳米材料的作用特点、毒代动力学和其他毒理学研究的结果等信息进行综合分析。遗传毒性试验组合可减少假阴性结果的风险。此外,任何一项遗传毒性试验中的阳性结果并不一定说明供试品对人类真正具有遗传毒性或致癌性的风险。
评价供试品的潜在遗传毒性时,应全面考虑各项试验结果、体内和体外试验方法的内在价值及其局限性,进行综合分析与评价。
a)体外遗传毒性
对于应用纳米材料医疗器械的遗传毒性评价,应优先开展体外遗传毒性试验。传统的细菌回复突变试验(Ames)体系存在一些局限,导致纳米材料不易与细菌的遗传物质充分接触,而有些纳米材料(如,纳米银及其释放的银离子等)自身也有一定的抑菌作用。因此,开展细菌回复突变试验时,应提供所用试验条件下细菌对该纳米材料摄取能力以及纳米材料溶解性的资料,作为结果判定的参考。小鼠淋巴瘤tk基因突变试验涵盖了基因突变和染色体断裂两个检测终点,可考虑作为第二项纳米材料潜在致突变能力的检测方法。体外微核试验或体外染色体畸变试验在检测终点上与Ames试验和小鼠淋巴瘤tk基因突变试验互补,可考虑任选一项作为第三项遗传毒性评价方法。在提供相应研究数据的同时应提供研究所用试验条件下细胞对该纳米材料摄取能力、纳米材料溶解性以及纳米材料对试验体系的干扰,作为试验结果判定的参考。
b)体内遗传毒性
首先应基于体外遗传毒性研究结果和GB/T 16886.3的要求评估是否需要开展体内遗传试验。
进行体内试验时,应证实纳米材料可在取材时间点到达取材的组织/器官。建议基于毒代动力学研究和/或亚慢性体内研究以确定取材组织/器官,并基于预期人群的接触途径和靶器官来制定应用纳米材料的医疗器械体内遗传毒性的评价策略。常用的体内遗传毒性试验包括:啮齿类动物红细胞微核试验、哺乳动物骨髓染色体畸变试验和啮齿类动物体内彗星试验。
(2)致癌性
体外和体内研究提示纳米材料可诱导DNA损伤和突变。基因突变、染色体损伤或重组等遗传物质损伤被认为具有遗传效应,也是决定恶性肿瘤多阶段发展的重要因素。某些致突变/遗传毒性化合物的暴露与致癌性之间存在明确相关性,遗传毒性试验结果对供试品的致癌性有一定提示作用。可根据具体纳米材料的作用特点及机制,并参考遗传毒性试验结果,决定是否有必要进一步开展致癌性试验。
另外,如果人体高剂量或长期暴露应考虑评估致癌风险。应根据GB/T 16886.3的要求考虑应用纳米材料的医疗器械致癌性评估,同时也可参考评估化学物致癌可能性的体内试验,如ECB.32及OECD 451中描述的致癌性试验和ECB.33及OECD 453描述的慢性致癌性联合试验。与两年致癌性研究相比,转基因动物,如鼠rasH2模型可用作短期替代试验。
在开展应用纳米材料医疗器械的致癌性实验时,需结合纳米材料的特性,可能的暴露途径和暴露方式,暴露时间等,科学合理地设计能够反映实际暴露情况的试验方案。
(3)生殖毒性
纳米材料具有能够穿透生殖系统屏障(例如血睾屏障和胎盘屏障等),影响精子的活力和功能以及胚胎发育的可能性。另外,纳米材料通过与DNA分子相互作用导致的遗传物质损伤也可能导致突变和影响下一代的生殖和发育。应根据GB/T 16886.3的要求和ADME的研究数据对应用纳米材料的医疗器械生殖毒性进行评估。
(五)风险评估
风险评估***重要的因素是纳米材料从医疗器械中释放的可能性,按照GB/T 16886.1要求进行风险评估。
与纳米材料释放相关的风险评估的阶段性方法在下面提出,并在图2中展示。
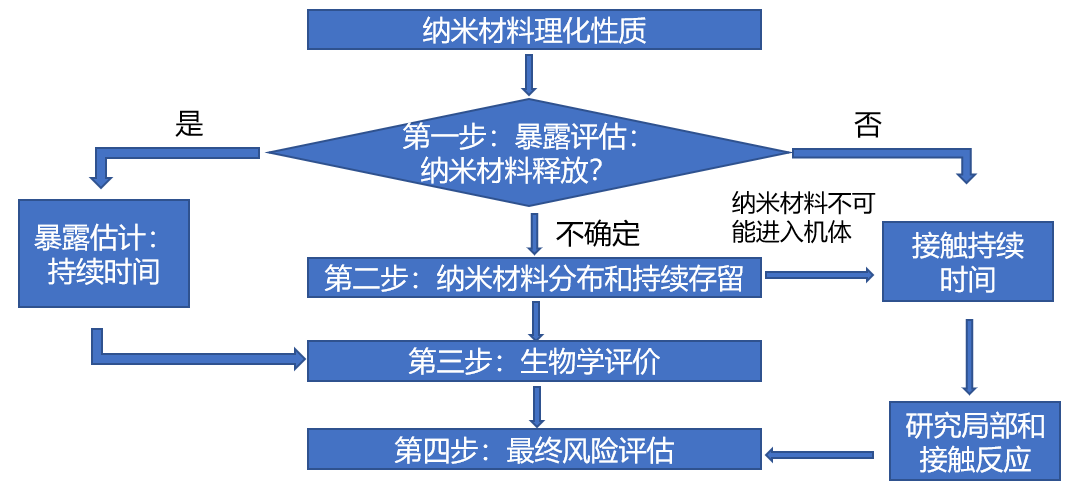
图2:应用纳米材料的医疗器械风险评估:阶段法
1.第一阶段:暴露评估(纳米材料释放)
第一阶段的目的是通过体外纳米材料释放实验,在模拟临床实际应用中***不利的情况下,考虑无论从材料的属性和应用类型,还是由于植入后的磨损,结合已有资料及文献分析,综合评估纳米材料释放的可能性以及潜在暴露风险。
当纳米材料存在释放的可能性时,需要进行理化表征以确定释放材料的性质、释放速率和可能对其产生影响的因素,并进一步开展生物学评价。如果纳米材料不存在释放的可能性,进一步评价可以仅限于局部反应。如果存在纳米材料潜在释放的不确定性,应开展第二阶段评估。
2.第二阶段:纳米材料分布和持续存留
这一阶段的主要目的是通过体内实验,识别游离纳米材料的生物分布和蓄积。可结合第五章第三部分毒代动力学内容进行评估,以应对在第三阶段(如下)中上述潜在暴露场景中所需的生物学评价。
无创(皮肤接触)和/或有创器械作用于人体部位所释放的纳米材料的吸收和接触持续时间,对纳米材料向其它器官的潜在分布具有重要影响,需进一步考虑纳米材料在其释放的生物介质中的持续存留/稳定性。
对于无创器械,首先需要评估纳米材料进入全身循环的潜力,如果能够得出在***差使用条件下,纳米材料都不可能进入全身循环,通常仅限于接触部位的局部反应。
对于有创器械,需要通过更详细的毒代动力学研究,评估游离的纳米材料进入并保留在特定组织中的潜力。从以上研究中的发现,可能影响下一步生物学评价方法的选择。
3.第三阶段:危害识别(生物学评价)
如果第一阶段和/或第二阶段没有识别出纳米材料的释放,医疗器械的局部效应可以参照GB/T 16886.1中已有的试验方法。
如果存在纳米材料释放,则需要附加试验。如果从第二阶段评估到纳米材料释放不太可能进入全身循环,则仅需进行局部效应的试验;如果当纳米材料在一个或多个组织暴露时,应考虑必要的附加试验,如ADME、免疫毒性、遗传毒性、亚慢性、慢性毒性、生殖毒性和神经毒性等试验。
为了能够客观地评估纳米材料的潜在风险,可能需要对现有的试验方法进行改进。
4.第四阶段:风险评估
当毒性由所用的(目标)纳米材料引起时,必须对剂量效应关系给予特别关注。在研究中的毒性反应与在靶器官(内部暴露)中检测到的纳米材料水平进行比较,以评价风险。评估的风险可以与不含纳米材料的可比医疗器械相比,并根据YY/T 0316进行评估。除评估出的潜在风险之外,在***终受益风险评价中也要考虑患者的潜在受益。
六、动物实验
医疗器械安全性和有效性评价研究应采用科学、合理的评价方法,其中动物实验是重要手段之一,其属于产品设计开发中的重要研究内容,可为产品设计定型提供相应的证据支持,可为医疗器械能否用于人体研究提供支持,降低临床试验受试者及使用者的风险以及为临床试验设计提供参考。结合动物实验的目的,一般从可行性、安全性和有效性三方面进行考虑。
本指导原则仅给出应用纳米材料的医疗器械动物实验的概述。有关动物实验的具体内容,将在本系列指导原则第四部分:应用纳米材料的医疗器械动物实验指导原则中给出。
(一)可行性
可行性研究是指产品设计开发阶段进行的,对产品工作原理、作用机理、设计、可操作性、功能性、安全性等方面进行确认/验证,或识别新的非预期风险的研究。
纳米技术是正在快速发展的新兴领域,在设计开发应用纳米材料的医疗器械时,会有许多新的工作原理、作用机理、设计和材料专属特性等理念出现,如何验证这些新理念是否可行以及器械性能是否有效,动物实验是重要的手段之一。
当通过台架试验或体外测试等试验不能完全评估其可行性时,可能需要通过动物实验来评估其可行性,如温敏纳米凝胶血管栓塞剂各组分不同比例的筛选,以及选择使用介入导管尺寸和材料的筛选等。
(二)安全性
相比于常规材料,由于纳米材料被认为可能穿越所有的保护屏障,包括血脑屏障和胎盘屏障等,因此,应用纳米材料的医疗器械可能需要考虑ADME以及全身毒性、中枢神经毒性和免疫毒性等。
同时由于纳米材料的特性,在对应用纳米材料的医疗器械的毒代动力学、毒理学以及生物学反应等方面进行评估和研究时,有些试验(如亚慢性毒性、植入后局部反应等)通过采用浸提液或与临床非一致的接触方式开展时,可能不足以模拟器械在临床上真实的沥滤物特征和生物学反应。应用纳米材料医疗器械浸提液的接触频率和部位与原位持续接触和释放的不同可能引起毒代动力学参数的差异,以及进一步引起毒性的差异,因此,相较于采用浸提液的部分生物学评价试验相比,动物实验可能会更有助于对应用纳米材料的医疗器械进行安全性评价。
当开展毒代动力学和毒理学研究与评价时,使用与临床一致原位暴露方式相对于使用浸提液的方式,有以下几方面的优势:
(1)避免应用纳米材料医疗器械基于GB/T16886.12制备浸提液的局限性。
(2)避免浸提液方式无法完全模拟临床可沥滤物真实的接触情况。
(3)与临床相同的原位暴露方式可以**地评估局部组织反应。
(4)在同一组动物身上同时评价局部反应、全身毒性和毒代动力学等,可对器械进行整体的安全性评估,也有利于结果的系统性解读。
采用动物实验研究对常规产品的部分安全性指标进行评价的项目,应用纳米材料的医疗器械同样适用。
(三)有效性
纳米技术是正在快速发展的新兴领域,大多数应用纳米材料的医疗器械还没有上市,在进行风险评估时,可能无法与已上市同类产品进行等同性比较。相关产品仅仅依靠常规的实验室研究并不能验证失效风险,也无法为临床试验设计提供足够的资料支持,因此,需要通过适宜的动物模型来评价应用纳米材料的医疗器械在动物体内的性能和产品有效性,如温敏纳米凝胶血管栓塞剂的血管栓塞性能评价,功能化纳米水凝胶肌组织修复材料引导组织重建的有效性评价等。
试验目的有时是不能严格划分界限的,因此一项动物实验可能同时对产品的可行性、安全性和有效性进行评价。
开展动物实验要在有资质的场所进行,并且该单位或机构应建立相应的质量管理体系,并维护体系保持有效运行,按照《医疗器械动物实验研究技术审查指导原则第一部分:决策原则》(2019年第18号)的要求进行。
在通过动物实验方式评价应用纳米材料医疗器械的生物相容性时,应符合GB/T 16886系列标准等生物学评价相关技术文件。
七、体外替代测试/计算机模拟研究
基于实验动物代替、减少和优化(3R)原则,在一些领域正在开发替代的试验方法,如体外替代测试和计算机模拟研究。在评价医疗器械安全性和有效性时,如果方法得到验证,可以考虑使用。另外,在一些器械性能方面研究或验证时,也可考虑使用该方法。
体外替代测试:目前包括皮肤腐蚀试验、皮肤刺激试验、经皮肤吸收试验、眼刺激试验、皮肤致敏试验、光毒性试验、内分泌干扰试验、胚胎毒性试验、血液毒性试验、遗传毒性、热原试验等毒理学测试。这些方法被欧洲药典、人用药品注册技术要求国际协调委员会(ICH)等法规接受。在确认了适用性基础上可以考虑采用体外替代测试方法。
计算机模拟研究:主要包括定量构效关系(QSAR, Quantitative Structure-Activity Relationship)、分类法、交叉参照、毒理学阈值和专家系统等。已经有不少QSAR模型和工具应用到毒理学安全性评估中,例如,OECD QSAR Toolbox、Toxtree、CAESAR、TEST及HESS等,其评价的毒性终点涉及经皮吸收、皮肤刺激、眼刺激、皮肤致敏、急性毒性、重复剂量染毒、生殖发育、遗传和致癌等。
目前,国内外发布的替代方法标准,对于工业化学品的部分毒性评价也能提供基本的测试数据。但在实际应用中仍需要积累数据,进行必要的优化和调整。使用者可以通过增加检测参数、改变暴露方式、修改预测模型和组合等不同方法提高方法的特异性。在选择体外替代测试和计算机模拟研究时,可根据国内法规要求选择相应的替代测试对纳米材料进行毒理学测试,必要时需要对方法进行优化和调整。
需要指出的是:当前科学界也正在开发用于纳米材料有效性评价和筛选的体外替代测试方法和计算机模拟方法,如体外三维组织/器官模型、有限元分析。这些方法对于现有的台架试验和动物实验是有益的补充。但申请人在采用这些方法对纳米材料开展评价时,也应充分考虑方法的局限性和适用性,特别是模型与真实人体健康组织和病变部位的差别对于结果解释造成的可能影响。有关体外替代测试和计算机模拟的具体内容,将在本系列指导原则第五部分:应用纳米材料的医疗器械体外替代测试/计算机模拟指导原则中给出。
八、临床评价
(一)一般考虑
本指导原则仅给出应用纳米材料医疗器械临床评价的概述。有关临床评价的具体内容,将在本系列指导原则第六部分:应用纳米材料的医疗器械临床评价指导原则中给出。
应用纳米材料的医疗器械临床评价应按照《医疗器械监督管理条例》《医疗器械注册管理办法》《医疗器械临床试验质量管理规范》和《医疗器械临床评价技术指导原则》等进行。
(二)临床试验
当前,大部分应用纳米材料的医疗器械未有人体使用史,无法与已上市产品进行同品种比对;另外由于动物与人体的差异,仅仅通过非临床研究,很难评价其安全性和有效性。因此,对于大部分应用纳米材料的医疗器械,需要开展临床试验。但通过对同品种医疗器械临床试验或者临床使用获得的数据进行分析评价,能够证明该医疗器械安全、有效的,可以在申报注册时予以说明,并提交相关证明资料。
需要开展临床试验的应用纳米材料的医疗器械应按照《医疗器械监督管理条例》《医疗器械注册管理办法》《医疗器械临床试验质量管理规范》,以及《医疗器械临床评价指导原则》等要求,合理设计临床试验方案;知情同意书设计要符合要求,重点描述风险、补偿、受益、替代治疗方案,不良事件的处理等。
(三)特殊考虑
除医疗器械临床试验的一般性要求外,在整个临床试验中,还应时刻关注纳米材料的潜在暴露风险,进行代谢学研究,以及医疗器械的性能研究。在长期安全性研究过程中,申请人宜根据医疗器械预期用途,纳米材料与人体可能的接触/暴露途径,以及纳米材料可能的靶器官/组织,设计有针对性的观察指标,全面评价应用纳米材料的医疗器械的安全性和有效性。
九、总结
对于应用纳米材料的医疗器械安全性和有效性评价,目前仍有许多问题尚未解决,但已有一些可用的工具、手段和标准,特别是与纳米材料安全性测试相关的工具,本指导原则已包含这些工具,申请人在对应用纳米材料的医疗器械安全性和有效性进行评价时,应尽可能采用已开发的新工具、手段和标准,并需要注意对应用纳米材料的医疗器械进行安全性和有效性评价时考虑一些特殊因素。
医疗器械中应用的纳米材料的潜在风险主要与游离纳米材料从器械释放的可能性,以及暴露剂量、暴露途径、接触部位和暴露时间相关。潜在释放取决于纳米材料使用方法(在器械中的存在形式),如游离纳米材料、固定在表面的纳米材料,或内嵌在基质中的纳米材料等。除纳米材料释放及其潜在效应之外,可能的使用部位的局部效应也应考虑。同时需要注意的是,即使医疗器械中不含纳米材料,医疗器械的磨损也可能导致纳米尺度颗粒的产生。此外,粒径大于100 nm的颗粒也存在一定的不同于常规材料的特性和安全风险,应用这类材料的医疗器械的安全性评价和风险评估也可参考本指导原则。
器械在真实世界环境中的使用情况可以**地体现器械的受益风险,所以,在对应用纳米材料的医疗器械做受益风险判定时,申请人和审评机构可以考虑将收集上市后数据作为风险控制措施的有效性方法。尤其当其识别出了新风险、确认特定的风险已被降低、识别出***有可能发生不良事件的患者、或者**体地区分出不同患者亚组对器械的响应,针对以上情况,及时做出应对措施,以降低其风险。
十、术语与定义
纳米尺度 nanoscale
处于1nm至100nm之间的尺寸范围。
注1:本尺寸范围通常、但非专有地表现出不能由较大尺寸外推得到的特性。对于这些特性来说,尺度上、下限值是近似的。
注2:本定义中引入下限(约1nm)的目的是为了避免在不设定下限时,单个或一小簇原子被默认为是纳米物体或纳米结构单元。
纳米材料 nanomaterial
任一外部维度、内部或表面结构处于纳米尺度的材料。
注1:本通用术语包括纳米物体和纳米结构材料。
注2:见工程化的纳米材料、人造纳米材料和伴生纳米材料。
注3:近些年随着科学界对纳米材料的认知逐渐增多,某一维度的尺寸在100nm至1000nm范围内,且表现出因尺寸而产生的特殊效应或现象的材料,该材料在本指导原则评价范围之内被认为是纳米材料。纳米材料的定义根据***新研究进展实时更新。
工程化的纳米材料 engineered nanomaterial
为了特定目的或功能而设计的纳米材料。
人造纳米材料 manufactured nanomaterial
为了商业目的而制造的具有特定功能或特定组成的纳米材料。
伴生纳米材料 incidental nanomaterial
在某一过程中作为副产品非特意产生的纳米材料。
注1:过程包括制造、生物技术或其他过程。
注2:见ISO/TS 27628: 2007, 2.21对“超细颗粒”的定义。
纳米物体 nano-object
一维、二维或三维外部维度处于纳米尺度的物体。
注:用于所有相互分离的纳米尺度物体的通用术语。
纳米颗粒 nanoparticle
三个维度的外部尺寸都在纳米尺度的纳米物体,其***长轴和***短轴的长度没有明显差别。
注:如果纳米物体***长轴和***短轴的长度差别显著(大于3倍)时,应用纳米纤维或纳米片来表示纳米颗粒。
纳米纤维 nanofibre
两个维度外部尺寸相近且处于纳米尺度,第三个维度尺寸特别大的纳米物体。
注1:***长的外部尺寸可不在纳米尺度。
注2:纳米纤维术语也可用nanofibril和nanofilament。
注3:见纳米颗粒注。
纳米片 nanoplate
一个维度外部尺寸在纳米尺度,其他两个维度外部尺寸明显大于***小尺寸的纳米物体。
注1:较大外部尺寸不必在纳米尺度。
注2:见纳米颗粒注。
纳米结构 nanostructure
一个或多个部分处于纳米尺度区域的相互关联的组成部分。
注:区域由性质不连续的边界来界定。
纳米结构材料 nanostructured material
内部或表面具有纳米结构的材料。
注:本定义不排除纳米物体具有内部或表面纳米结构的可能性。如果外部维度(一个或多个)处于纳米尺度,推荐用术语“纳米物体”。
纳米技术nanotechnology
应用科学知识操纵和控制纳米尺度的物质以利用与单个原子、分子或块体材料性质显著不同的、与尺寸和结构相关的性质和现象。
注:操纵和控制包括材料合成。
聚集体 aggregate
强束缚或融合在一起的颗粒构成的新颗粒,其外表面积可能显著小于其单个颗粒表面积的总和。
注1:支持聚集体的力都是强作用力,如共价键或源于由烧结或复杂的物理缠结。
注2:聚集体也被称为次级颗粒,而源颗粒则被称为初级颗粒。
团聚体 agglomerate
弱束缚颗粒的堆积体、聚集体或两者的混合体,其外表面积与单个颗粒的表面积总和相近。
注1:支撑团聚体的作用力都是弱力,如范德华力或简单的物理缠结。
注2:团聚体也被称为次级颗粒,而源颗粒则被称为初级颗粒。
溶解度 solubility
溶质在溶剂中的溶解能力。用其在平衡条件下的***大溶解量表示。如固溶度、溶水度等。
比表面积 specific surface area
单位质量粉末或多孔体具有的总表面积。
十一、参考文献
1.欧盟新兴与新识别健康风险委员会《医疗器械中应用的纳米材料潜在健康效应指导原则》Guidance on the Determination of Potential Health Effects of Nanomaterials Used in Medical Devices,Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR)2015
2.ISO/TR 10993-22:2017《Biological evaluation of medical devices—Part 22: Guidance on nanomaterials》
3.GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价和测试》
4.YY/T 0993《医疗器械生物学评价纳米材料:体外细胞毒性试验(MTT试验和LDH试验)》
5.YY/T 1295《医疗器械生物学评价纳米材料:细菌内毒素试验》
6.YY/T 1532《医疗器械生物学评价纳米材料溶血试验》
7.YY/T 0316《医疗器械风险管理对医疗器械的应用》
8.GB/T 16886.9《医疗器械生物学评价–第9部分:潜在降解产物的鉴别和定量框架》
9.GB/T 16886.13《医疗器械生物学评价–第13部分:聚合物医疗器械降解产物鉴别和定量》
10.GB/T 16886.14《医疗器械生物学评价–第14部分:陶瓷降解产物的鉴别和定量》
11.GB/T 16886.15《医疗器械生物学评价–第15部分:金属和合金降解产物的鉴别和定量》
12.GB/T 16886.18《医疗器械生物学评价–第18部分:材料化学表征》
13.GB/T 16886.19《医疗器械生物学评价–第19部分:材料理化、形态学和形貌学表征》
14.欧盟员会建议(2011/696/EU)(EC 2011)
15.《国家药监局关于发布医疗器械安全和性能的基本原则的通告》(2020年第18号)
16.《医疗器械动物实验研究技术审查指导原则第一部分:决策原则》(2019年第18号)
17.《医疗器械产品受益-风险评估注册技术审查指导原则》(2019年第79号)
18.《国家食品药品监督管理总局关于发布医疗器械临床评价技术指导原则的通告》(2015年第14号)
19.《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
20.《医疗器械临床试验质量管理规范》(国家食品药品监督管理总局 中华人民共和国国家卫生和计划生育委员会令第25号)
21.ISO/TR 13014,Nanotechnologies-Guidance on physico -chemical characterization of engineered nanoscale materials for toxicologic assessment
22.GB/T 30544.1《纳米科技 术语 第1部分:核心术语》
23.GB/T 30544.4《纳米科技 术语 第4部分:纳米结构材料》
24.Nanotechnologies in medical devices.RIVM Report 2015-0149
十二、编写单位
本指导原则由国家药品监督管理局医疗器械技术审评中心牵头,国家纳米科学中心、广东粤港澳大湾区国家纳米科技创新研究院、中国食品药品检定研究院参与编写,由国家药品监督管理局医疗器械技术审评中心负责解释。

