隐球菌荚膜多糖抗原检测试剂注册技术审查指导原则(2021年第4号)
本指导原则旨在指导注册申请人对隐球菌荚膜多糖抗原检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对隐球菌荚膜多糖抗原检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、范围
隐球菌病是一种由隐球菌感染引起的深部真菌病,可累及全身多个系统。隐球菌属内对人致病的***主要病原菌是新生隐球菌(Cryptococcus neoformans)和格特隐球菌(Cryptococcus gattii)。根据新生隐球菌荚膜多糖成分和生化方面的差异,将新生隐球菌分成2个变种(新生隐球菌新生变种C.neoformans var.neoformans和新生隐球菌格鲁比变种C.neoformans var.grubii),按血清学分为A、B、C、D和AD型5个型。其中新生变种为血清D、AD型,欧洲、南美洲流行;格鲁比变种为血清A型,全球流行;格特隐球菌为血清B、C型,在热带\亚热带\温带流行;我国血清型主要为A型。此外,还发现了新生变种与格鲁比变种的杂合体(血清型AD)。隐球菌的基因型包括新生隐球菌的VNⅠ、Ⅱ、Ⅳ、B和格特隐球菌的VGI-VGIV。两种隐球菌的无性繁殖体均为无菌丝的单芽孢酵母菌,在体外为无荚膜或仅有小荚膜,进入人体内后很快形成厚荚膜,有荚膜的隐球菌菌体直径明显增加,致病力明显增强。隐球菌荚膜的主要成分荚膜多糖是确定血清型特异性的抗原基础,并与其毒力、致病性及免疫性密切相关。隐球菌是一种机会感染性真菌,既可侵犯免疫力低下及免疫缺陷人群,也可发生于免疫正常者,可以感染人体的任何组织和脏器,***常见的部位是中枢神经系统,其次是肺部和皮肤。
中枢神经系统隐球菌感染通常表现为脑膜炎或脑膜脑炎,极少数表现为单个或多个局灶性肿块损害(隐球菌肉芽肿),中枢神经系统感染可伴发肺部或其他播散性感染,但大多数不伴有其他感染的临床表现。隐球菌感染中枢神经系统外的器官和部位,肺和皮肤是常见的两个部位。肺是隐球菌感染的主要门户,肺隐球菌感染的临床表现多种多样,可从无症状的结节到严重的急性呼吸窘迫综合征(ARDS)。皮肤隐球菌感染根据感染来源,可以分为原发性和继发性感染两种。继发性隐球菌感染一般预示已经发生播散性隐球菌感染,主要来源于血行播散,提示感染严重。
隐球菌感染的病原学及实验室检测包括隐球菌的微生物学鉴定,隐球菌病的免疫学诊断(血清学实验),隐球菌的药物敏感试验和隐球菌病的组织病理学。其中隐球菌病的免疫学诊断(血清学实验)临床上常用的为隐球菌荚膜多糖抗原检测,其方法有乳胶凝集试验(Latex Agglutination test ,LA)、酶联免疫分析法(Enzyme Immunoassay ,EIA)及侧向免疫层析法(Lateral Flow Immunoassay ,LFA)等。隐球菌荚膜多糖抗原检测可辅助诊断隐球菌感染,隐球菌荚膜多糖抗原阳性提示隐球菌感染,脑脊液中隐球菌荚膜多糖抗原滴度的高低可提示疾病的严重程度。隐球菌荚膜多糖抗原检测因其简单、快速已经是目前国内临床辅助诊断隐球菌感染***常用的方法之一。
本指导原则适用于利用酶联免疫法、乳胶凝集试验和侧向免疫层析法等基于抗原抗体反应原理,对来源于血清和/或血浆和/或全血和/或脑脊液等人体样本中的隐球菌荚膜多糖抗原进行体外定性检测的试剂。结合临床和其他实验室指标,可用于隐球菌感染的辅助诊断。如涉及半定量检测试剂,或待测样本类型为血清、血浆、全血、脑脊液外其他样本类型(如尿液、肺泡灌洗液),应对半定量或其他样本类型的性能进行研究,并根据申请的预期用途设计临床试验进行验证。可适量参考本指导原则相关要求。
本指导原则仅包括对隐球菌荚膜多糖抗原检测试剂申报资料中部分项目的要求,适用于进行产品注册和相关许可事项变更的产品。其他未尽事宜,应当符合《体外诊断试剂注册管理办法》(原国家食品药品监督管理总局令第5号)(以下简称《办法》)、《体外诊断试剂注册申报资料基本要求》(原国家食品药品监督管理总局公告2014年第44号)等相关法规和文件的要求。
二、注册申报资料要求
(一)综述资料
综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容。其中,需注意以下内容:
1.产品预期用途
详述检测试剂的预期用途,包括预期人群、适用的样本类型,检测结果的临床指导意义等。描述隐球菌的生物学特征、隐球菌感染疾病相关流行病学、潜伏期、易感人群、临床表现等。说明现有的临床或其他实验室诊断方法等。
2.同类产品上市情况
应着重从技术方法及预期用途(包括预期人群、样本类型、临床意义)等方面写明拟申报产品与现行临床诊断方法,以及目前市场上已获批准的同类产品之间的主要异同点。
(二)主要原材料研究资料
此产品的主要原材料包括抗体、质控品(如适用)以及企业参考品等。应提供主要原材料的选择与来源、制备过程、质量标准等研究资料。如主要原材料为企业自制,应明确原材料的制备原理,简述制备过程及质量标准,其生产工艺必须相对稳定;如主要原材料为外购,应提供的资料包括:原材料的筛选研究资料、供应商选择的研究资料、质量标准、供应商出具的主要原材料检验报告(质量证书)和入厂检验报告等。供应商为原材料的生产商,不得随意更换。
主要原材料的筛选研究资料,应包含试验方法、实验数据及分析。质量控制标准应包括相应试验方法及原材料应达到的客观评价标准。人源或其他生物源性原材料质量控制标准中还应包含生物安全指标。生产企业应依据质量控制标准对原材料进行检验,检验合格方可用于生产。
1.抗体
应明确抗体名称、生物学来源、免疫原、供应商名称、质量标准(一般包括外观、蛋白纯度、浓度、效价、分子量、功能性试验)等。
如为自制抗体,还需明确抗体所针对的抗原表位、免疫原的具体信息,包括天然抗原的来源、重组或人工合成抗原的序列信息及制备方法。同时提交抗体制备、筛选、鉴定等详细试验资料。
2.其他主要原辅料
包括基于酶联免疫技术的固相载体,如酶标板、微粒等;基于凝集反应的乳胶颗粒等;基于侧向免疫层析技术的金颗粒、硝酸纤维素膜等。申请人应提交上述原材料的选择依据及验证资料,明确供应商名称及原材料质量标准。
3.试剂盒质控品(如有)
应包括原料来源、质控品制备、阴阳性确认和质量标准等相关研究资料。质控品应至少包含阴性和阳性两个水平。阳性质控品可选择标准菌株或经鉴定、可溯源的临床分离株或荚膜多糖抗原。如荚膜多糖抗原为企业自制,请详述制备的方法。提交质量标准中各项指标,如浓度、纯度测定的方法及结果。
4.企业参考品(如适用)
应提交企业参考品的原料选择、制备、阴阳性及浓度/滴度确认等相关验证资料。说明参考品阴阳性及浓度/滴度确认的方法或试剂(建议采用国内已上市的、临床上普遍认为质量较好的同类试剂)。参考品可采用临床真实样本,亦可采用标准菌株或临床分离株添加入待测样本基质的形式制备。企业参考品的基质应与待测样本相同,需涵盖所有待测样本基质。企业参考品的设置建议如下:
4.1阳性参考品
阳性参考品应考虑覆盖不同种及不同型别的隐球菌感染样本。建议包含隐球菌A、B、C、D和AD血清型,或新生隐球菌VNⅠ、Ⅱ、Ⅳ、B基因型和格特隐球菌VGI-VGIV基因型。参考品应设置不同浓度水平。
4.2阴性参考品
阴性参考品应考虑检测特异性的评价,纳入正常临床样本、含类风湿因子等干扰因素的样本及其他病原体阳性样本,可选择多个病原体标准菌株或临床分离株,包含常见真菌(见表1)。
4.3检测限参考品
可设置不同滴度的临床阳性样本或荚膜多糖抗原或临床阳性样本的系列梯度浓度样本,样本基质与检测样本一致,其中应包含检测限水平。
4.4精密度参考品
建议至少包含中阳性和弱阳性,至少两个浓度水平的参考品。
(三)主要生产工艺及反应体系的研究资料
1.产品基本反应原理介绍。
2.主要生产工艺介绍,可用流程图方式表示,并简要说明主要生产工艺的确定依据。
3.胶体金的制备及金颗粒大小确定的研究(如适用)。
4.包被/标记工艺研究,申请人应考虑,包被/标记液量、pH值、浓度、时间等指标对产品性能的影响,通过实验确定上述指标的***佳组合。
5.膜干燥工艺的确定,申请人应对不同干燥条件(时间、温度)下的试剂性能及稳定性进行研究。(如适用)
6.反应条件确定:申请人应考虑反应时间、反应温度、洗涤次数等条件对产品性能的影响,通过实验确定上述条件的***佳组合。
7.反应体系中样品加样方式及加样量确定:通过实验确定***佳的加样方式及加样量。如样本需采取稀释或其他必要的方法进行处理后方可用于***终检测,申请人还应对可用于样本稀释的物质或处理方法进行研究,通过实验确定***终选择的用于样本稀释的物质或处理方法。
8.显色系统、酶作用底物等的介绍以及***适条件研究。(如适用)
(四)分析性能评估资料
申请人应提交在符合质量管理体系的生产环境下生产的试剂盒进行性能评估研究。对于每项分析性能的评价都应包括具体研究目的、实验方法、可接受标准、实验数据、统计方法等详细资料。有关分析性能验证的背景信息也应在申报资料中有所体现,包括实验地点、使用仪器、试剂规格、批号、临床样本来源、研究用样本性质和浓度确定的方法等。
分析性能评价的实验方法可以参考国际或国内有关体外诊断试剂性能评估的指导原则进行。对于此类产品,性能评估中所用样品(除非特别说明)可参考上述企业参考品的制备要求。各项性能评价应符合以下要求。
1.适用的样本类型
如果申报试剂适用于多种样本类型,应采用合理方法评价每个样本类型的适用性。对于可比样本,可采用同源比对的方法进行验证;对于不可比样本,应对每个样本类型分别进行性能评估,至少包括精密度、干扰试验、***低检出限和包容性。此处所述可比样本,一般指:性能指标相同、阳性判断值相同、预期人群一致、临床意义相同。反之,则应视为不可比样本。
2.准确度
申请人可选择下述两种方式或两种方式之一进行准确度研究。
2.1方法学比对
采用对系列样本检测的方式,比较检测结果与临床诊断结果或已上市试剂检测结果之间的差异。
样本应选择预期人群的样本,并注意包含不同水平的隐球菌荚膜多糖抗原及隐球菌的不同型别,且包含干扰及交叉样本。
2.2企业内部参考品检测
通过检测企业内部阴、阳性参考品,评价申报试剂的检测准确性。
3.***低检测限(分析灵敏度)
3.1***低检测限的建立
建议采用对来自不同型别隐球菌的,已知浓度的荚膜多糖抗原样本,进行系列稀释后重复检测的方法,确定申报试剂的检出限。稀释时应注意采用待测样本类型进行稀释。在上述重复检测过程中,记录不同稀释度/浓度检出(或阳性)的结果。采用适当的模型,计算申报试剂在设定概率下的检出限,一般在该检测浓度下应具有95%的可能性检出。
3.2***低检测限的验证
申报试剂应在检测限浓度水平对来自不同型别隐球菌的隐球菌荚膜多糖抗原的检出进行验证。一般采用对检出限浓度水平样本进行至少20次的重复试验的方法对检出限进行验证。
4.包容性
应证明申报试剂具有检出不同型别隐球菌中荚膜多糖抗原的能力。不同型别包括:我国有报道的隐球菌感染种类,如新生隐球菌和格特隐球菌的五个血清型别或基因型为新生隐球菌VNⅠ、Ⅱ、Ⅳ、B和格特隐球菌的VGI-VGIV;其他隐球菌属,如浅白隐球菌C. albidus、土生隐球菌C. humicola。应采用略高于检出限浓度的各型别样本进行重复检测研究。该样本可以为灭活的临床样本或标准菌株。
5.分析特异性
5.1交叉反应
用于隐球菌荚膜多糖抗原交叉反应验证的病原体种类主要考虑以下几方面:抗原结构具有同源性(如隐球菌在真菌分类学上的近缘菌)、易引起相同或相似的临床症状、采样部位正常寄生或易并发的其他病原体,具体目录参见表1。
建议选择高浓度交叉反应物水平进行验证,细菌或者真菌的***低浓度为106 CFU/mL。对于交叉反应中病原体的***低浓度,申请人也可根据病原体的具体特性规定相应浓度及浓度单位。临床收集的样本应提供用于交叉反应验证的病原体的来源、种属和浓度信息,标准菌株还应同时提供制备方法。
表1 建议进行交叉反应评估的病原体类别
| 白念珠菌 | 热带念珠菌 | 近平滑念珠菌 |
| 克柔念珠菌 | 光滑念珠菌 | 毛霉 |
| 根霉 | 土曲霉 | 烟曲霉 |
| 黑曲霉 | 黄曲霉 | 孢子丝菌 |
| 阿萨希毛孢子菌 | 酿酒酵母 | 红酵母 |
| 结核分枝杆菌 | 肺炎支原体 | 肺炎链球菌 |
5.2干扰物质
5.2.1内源性及外源性干扰
干扰物质包括内源性干扰物质和外源性药物。内源性干扰物质应至少包括:血红蛋白、胆红素、甘油三酯(血清/血浆/全血适用)、类风湿因子、自身抗体等;外源性药物应包含表2中内容。
建议申请人在每种干扰物质的潜在***大浓度(***差条件)对包含隐球菌荚膜多糖抗原弱阳性在内的至少两个浓度水平的临床样本进行干扰影响研究。对于常见药物干扰试验,建议参照相应药物药代动力学研究确定的治疗药物浓度添加相应药物进行干扰验证。
表2 用于进行干扰研究的外源性药物
| 阿莫西林 | 卡泊芬净 | 阿尼芬净 |
| 两性霉素B | 氟胞嘧啶 | 氟康唑 |
| 伊曲康唑 | 伏立康唑 | 泊沙康唑 |
5.2.2抗凝剂的干扰
如果试剂盒适用样本类型包括血浆和/或全血样本,可采用一定数量血清、血浆、全血同源样本进行对比试验的方法,或采用回收试验的方法,验证各种抗凝剂的适用性。
6.精密度
申请人应对每项精密度指标的评价标准做出合理要求,如变异系数的范围和显色强度等。研究资料应包括时间、地点、操作人员、检测次数、所用试剂批次、样本浓度、适用仪器(如适用)、研究过程以及结果分析方法等。应考虑以下几个方面:
6.1对可能影响检测精密度的主要变量进行验证:除申报试剂本身外,还应对不同时间、地点、不同仪器(如适用)、操作人员、测试运行间的差异进行相关的验证。
6.2设定合理的精密度评价周期。
6.3应采用临床样本进行精密度研究。
6.4研究样本应至少包括四个水平,具体要求如下:
6.4.1阴性样本:不含待测靶物质的样本,全部为阴性。
6.4.2高值阴性样本(如C5):浓度略低于***低检测限,阴性率应≥95%(n≥20)。
6.4.3临界阳性样本:阳性检出率应≥95%(n≥20)。
6.4.4中等强度阳性样本:阳性检出率应为**,CV结果应在合理的可接受范围内(如适用)。(n≥20)。
7.钩状(HOOK)效应
建议采用高浓度的隐球菌荚膜多糖抗原样本进行梯度稀释后分别检测,每个梯度重复3至5次,将显色深度或检测值随浓度升高反而变浅或降低时的浓度,作为不出现钩状效应时隐球菌荚膜多糖抗原***高浓度。
(五)阳性判断值确定资料
申请人应根据具体情况选择适当的方法,如受试者工作特征曲线(ROC)的分析方式,来确定合理的阳性判断值。若试验结果存在灰区,则应明确灰区建立的基础。试验所用样本来源应考虑到地域、年龄、职业、是否接受抗菌治疗等因素的影响。如果申报产品包含不可比的样本类型,如血清和脑脊液,请分别对两种样本类型进行阳性判断值的确定和验证。
申请人应提交具体的试验方案、评价标准、统计学分析、研究数据等研究资料。
(六)稳定性研究资料
稳定性研究资料主要涉及两部分内容,申报试剂的稳定性和适用样本的稳定性研究。前者主要包括实时稳定性、运输稳定性、开瓶/开封稳定性(如涉及)及冻融稳定性(如涉及)等研究,申请人可根据实际需要选择合理的稳定性研究方案。稳定性研究资料应包括研究方法的确定依据、具体的实施方案、详细的研究数据以及结论。对于实时稳定性研究,应提供至少三批样品在实际储存条件下保存至成品有效期后的研究资料。运输稳定性的研究,注意包含详尽的运输条件描述、运输过程中的实时监控数据,并包含至少一批试剂,运输后至效期的验证资料。
样本稳定性一般包括样本各种实际运输及储存(常温、冷藏和冷冻)条件下的保存期限验证,以确认样本的保存条件及时限(短期、长期)。需要冷冻保存的样本同时应对冻融次数进行合理验证。
试剂稳定性和样本稳定性两部分内容的研究结果应在说明书【储存条件及有效期】和【样本要求】两项中进行详细说明。
(七)临床评价资料
临床试验的开展应符合相关法规、文件的要求。临床试验资料应符合《体外诊断试剂临床试验技术指导原则》(原国家食品药品监督管理总局通告2014年第16号)要求。
1.样本类型
对于样本类型为脑脊液的产品,其预期用途一般用于隐球菌性脑膜炎的辅助诊断。
对于样本类型为血清的产品,其预期用途一般用于隐球菌病(包括肺、中枢神经系统或皮肤等隐球菌各部位感染)的辅助诊断。
当申报样本类型还包括血浆或全血时,应通过与临床参考标准进行比较研究或同源样本比对的方法确认临床性能。
2.受试人群
对于脑脊液样本类型,受试人群应为疑似隐球菌性脑膜炎患者,应包括免疫功能正常人群和免疫功能低下人群。
对于血清样本类型,受试人群应为疑似隐球菌病患者(包括肺、中枢神经系统或皮肤等各部位疑似隐球菌感染的患者),应包括免疫功能正常人群和免疫功能低下人群。
应考虑流行病学特征,纳入不同地区的患者/人群,以验证本产品的临床性能。
为考察产品的临床特异性,应适当纳入干扰和易产生交叉反应的样本。针对血清样本类型,建议纳入部分类风湿因子阳性患者样本、系统性红斑狼疮患者样本以及毛孢子菌属感染患者样本。针对脑脊液样本类型,建议纳入部分细菌性脑膜炎(革兰阳性、革兰阴性分别应有纳入)患者样本,结核性脑膜炎患者样本,病毒性脑膜炎样本以及自身免疫性脑炎患者样本。
临床试验应包含一定数量的新鲜样本。冻存样本和新鲜样本的检测结果如有差异应分别统计。
3.对比方法
对于脑脊液样本类型,可选择已上市同类产品或临床参考标准进行盲法同步比较,验证试验用体外诊断试剂的临床性能。
对于血清样本类型,可选择已上市同类产品进行比较研究试验或采用试验用体外诊断试剂与临床参考标准进行盲法同步比较,验证试验用体外诊断试剂的临床性能。
对于肺隐球菌感染的临床参考标准包括:组织病理检查,无菌部位标本病原学涂片和培养。对于隐球菌性脑膜炎的临床参考标准包括:脑脊液病原学涂片和培养,脑脊液隐球菌荚膜多糖抗原检测。
4.样本量
适当的样本量是保证申报产品临床性能得到准确评价的必要条件。临床试验样本量应满足统计学要求,可采用适当的统计学方法进行估算。
4.1 采用已上市同类产品进行比对研究:隐球菌抗原检测试剂为定性检测产品,如临床试验采用申报产品与已上市同类产品进行比对的试验设计,可采用单组目标值法样本量公式估算***低样本量。
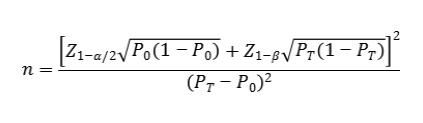
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平和把握度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为试验用体外诊断试剂评价指标预期值。
对于脑脊液样本,样本量估算过程中,建议评价指标的临床可接受标准(P0)即隐球菌抗原试剂临床阴/阳性符合率大于95%。
4.2 对于血清样本类型,如采用临床参考标准进行比对研究,建议对样本量进行统计学估算,隐球菌性脑膜炎患者样本量应满足统计学要求,可采用单组目标值法样本量公式估算***低样本量。隐球菌性脑膜炎样本量估算过程中,建议评价指标的灵敏度特异度临床可接受标准(P0)大于95%。
建议纳入不少于30例肺隐球菌感染确诊病例,并适量纳入除中枢神经系统和肺以外其他部位隐球菌感染患者。
样本量估算过程中需要考虑临床试验中病例的剔除率,一般而言,病例剔除率不应高于10%。
临床试验样本量除需满足上述统计学估算的***低样本量要求外,还应保证入组病例覆盖受试者的各种特征。如临床试验研究有更合理的样本量估算方式,在说明其合理性后亦可采用。
5.试验方案
临床试验实施前,研究人员应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学合理的临床研究方案。各临床研究机构的方案设置应基本一致,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。整个试验过程应在临床研究机构的实验室内并由本实验室的技术人员操作完成,申报单位的技术人员除进行必要的技术指导外,不得随意干涉实验进程,尤其是数据收集过程。在试验操作过程中和判定试验结果时应采用盲法以保证试验结果的客观性。各研究单位选用的对比试剂/方法应保持一致,以便进行合理的统计学分析。
试验方案中应确定病例纳入/排除标准,任何已经入选的病例再被排除出临床研究都应记录在案并明确说明原因。应对检测样本的类型和数量提出要求。应明确统计检验假设,如评价试验用体外诊断试剂与对比试剂是否等效的标准,并提出适合的数据统计分析方法。
临床试验中如有体外诊断试剂与对比方法检测结果不一致的情况,应对不一致结果进行综合分析,说明是否影响对产品临床性能的判定;对检测结果不一致样本可采用临床参考标准或其他恰当的方法进行确认,但该确认结果不应纳入原有统计分析。
6.统计学分析
应选择合适的统计方法对临床试验结果进行统计分析。对于此类定性检测试剂与已上市同类产品或参比方法的比较研究试验,常选择配对四格(2×2)表或列联表的形式总结试验用体外诊断试剂与对比试剂/参比方法的检测结果,计算阳性符合率、阴性符合率、总符合率以及95%置信区间,kappa值等指标。
对于血清样本类型与临床参考标准对比的分析,统计分析常选择四格(2×2)表形式对结果进行总结,并据此计算申报产品临床灵敏度和特异度及其置信区间。对于肺隐球菌感染,隐球菌性脑膜炎和其他类型隐球菌感染患者需进行分层统计。
(八)产品技术要求
申请人应当在原材料质量和生产工艺稳定的前提下,根据申请人产品研制、前期评价等结果,依据国家标准、行业标准及相关文献,按照《医疗器械产品技术要求编写指导原则》(原国家食品药品监督管理总局通告2014年第9号)的有关要求,编写产品技术要求。
隐球菌荚膜多糖抗原检测试剂的产品性能指标应主要包括:物理性状、阴/阳性参考品符合率、精密度、***低检测限等。阳性参考品主要考察对隐球菌荚膜多糖抗原的阳性检出能力,阴性参考品则重点对分析特异性进行验证。
如果申报试剂已有适用的国家标准品、参考品发布,则申请人应在产品技术要求中提出检验要求。
按照《办法》的规定,此类产品为第三类体外诊断试剂,申请人应按照《医疗器械产品技术要求编写指导原则》的要求,以附录形式明确主要原材料、生产工艺及半成品要求,附录的编制应符合相关编写规范的要求。在附录中列明本指导原则“主要原材料研究资料”中提及的所有适用原材料的要求。
(九)产品说明书
产品说明书是体外诊断试剂注册申报***重要的文件之一。产品说明书的格式应符合《体外诊断试剂说明书编写指导原则》(原国家食品药品监督管理总局通告2014年第17号)的要求,进口体外诊断试剂的中文说明书除格式要求外,其内容应尽量保持与原文说明书的一致性,翻译力求准确且符合中文表达习惯。产品说明书中相关技术内容均应与申请人提交的注册申报资料中的相关研究结果保持一致,如某些内容引用自参考文献,则应以规范格式对此内容进行标注,并单独列明文献的相关信息。
结合《体外诊断试剂说明书编写指导原则》的要求,下面对隐球菌荚膜多糖抗原检测试剂说明书的重点内容进行详细说明,以指导注册申报人员更合理地完成说明书编制。
1.【预期用途】
1.1对于样本类型为脑脊液的产品,试剂盒用于体外定性检测人脑脊液中隐球菌荚膜多糖抗原,用于隐球菌性脑膜炎的辅助诊断。
对于样本类型为血清或/和血浆或/和全血的产品,试剂盒用于体外定性检测人血清或/和血浆或/和全血样本中隐球菌荚膜多糖抗原,用于隐球菌病的辅助诊断。
1.2结合临床和其他实验室指标,明确检测的临床意义。
1.3临床背景描述:简单介绍病原体的生物学特征、流行病学、潜伏期、易感人群、感染后的临床表现及相关疾病等。简要介绍现有隐球菌感染的临床或实验室诊断方法。
2.【主要组成成分】
2.1说明试剂盒包含组分的名称、数量、比例或浓度等信息,质控品应明确具体基质成分和浓度水平。对于胶体金试剂应描述试剂条/卡结构组成及检测试剂包含的稀释液等组分。
2.2介绍检测中使用的抗体信息及标记物信息,包括抗体的动物源性、抗体的性质(单克隆或多克隆)、标记物种类等。
2.3试剂盒中不包含但对该项检测必须的组分,企业应列出相关试剂的名称、注册证号/备案号(如有)、货号、生产商等其他相关信息。
3.【储存条件及有效期】
详细介绍试剂盒的效期稳定性、开瓶/开封稳定性、运输稳定性等信息。
对于基于侧向免疫层析技术的检测试剂,开封稳定性应同时注明,开封条件:包括湿度和温度。对于酶免疫技术的检测试剂,应至少注明试剂盒内质控品和校准品(如适用)的开瓶稳定性。
运输稳定性的描述,应基于研究资料,客观描述运输条件、运输过程中的温度范围、运输时限、开箱温度等内容。
4.【适用机型】(如适用)
对于采用酶联免疫吸附法的检测试剂应明确适用酶标仪的波长要求,其他方法学检测试剂应明确具体的适用机型型号。
5.【样本要求】重点明确以下内容
5.1样本的采集:明确推荐的采集时间、采集顺序、采集量等,样本的取材及处理方式等,若有通用的技术规范或指南,则应遵循,并在此处引用。
5.2样本类型:明确样本类型,对于血浆/全血样本,应注明对抗凝剂的要求。
5.3样本处理及保存:样本处理方法、保存条件(如冷藏、冷冻等)及不同保存条件下的保存时限和运输条件等。冷藏、冷冻样本检测前是否需要恢复室温,冷冻样本的冻融次数限制等。
6.【检验方法】
详细说明试验操作的各个步骤:
6.1实验环境:实验室的温度、湿度要求。
6.2试剂配制方法,试剂开封后使用方法等。
6.3高浓度样本稀释的方法。
6.4试验条件:操作步骤、温度、时间、仪器波长等。
6.5质量控制:操作步骤,质控结果的要求(试验有效性的判断),质控结果不符合要求的处理方式。
6.6对于胶体金法检测试剂可以彩图图示形式显示正确的检验操作方法、程序及注意事项等。特别注意应强调操作温度及湿度条件、读取结果的时间。
6.7特别说明检验操作过程中的注意事项。
7.【检验结果的解释】
详细描述检测结果的判定标准或计算方法,如有灰区判定,应详细说明灰区样本的处理方法。
基于侧向免疫层析技术的检测试剂,应以彩图的形式显示结果的判读方法。
检验结果的解释应结合相应的临床诊疗指南进行描述。
8.【检验方法局限性】
列明假阴性和假阳性结果出现的可能情形。
综合产品的预期用途、临床背景、检测方法及适用范围等信息,对可能出现的局限性进行相关说明。
9.【产品性能指标】
详述以下性能指标:
9.1对相应国家参考品(如有)检测的符合情况。
9.2准确性:简述研究用样本性质、例数和评价结果。
9.3 ***低检测限和包容性:简要介绍评价方法、所用隐球菌菌株或样本情况以及评价结果。
9.4分析特异性
9.4.1交叉反应:简述交叉反应验证的病原体种类,及有/无交叉反应的浓度水平。
9.4.2干扰物质:简述评价的干扰物质种类及有/无干扰反应的浓度水平。
9.5精密度:简述试验方法及各项精密度研究结果。
9.6钩状(HOOK)效应:对高浓度荚膜多糖抗原钩状效应的验证情况进行总结。
10.【注意事项】
应至少包括以下内容:
10.1有关试剂盒内人源组分(如有)生物安全性的警告。如:试剂盒内对照品(质控品)或其他可能含有人源物质的组分,虽已经通过了乙型肝炎病毒表面抗原(HBs-Ag)、人类免疫缺陷病毒1/2型抗体(HIV1/2-Ab)、丙型肝炎病毒抗体(HCV-Ab)等项目的检测,结果为阴性,但截至目前,没有任何一项检测可以确保**安全,故仍应将这些组分作为潜在传染源对待。
10.2试验室应具有Ⅱ级生物安全防护能力。
10.3有关实验操作、样本保存及处理等其他注意事项。
三、参考文献
1.《体外诊断试剂注册管理办法》(原国家食品药品监督管理总局令第5号).2014年7月
2.《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(原国家食品药品监督管理总局公告2014年第44号).2014年9月
3.《体外诊断试剂临床试验技术指导原则》(原国家食品药品监督管理总局通告2014年第16号).2014年9月
4.《体外诊断试剂说明书编写指导原则》(原国家食品药品监督管理总局通告2014年第17号).2014年9月
5.《中国真菌学杂志》编辑委员会.隐球菌感染诊治专家共识[J].中国真菌学杂志,2010,5(2):65-68+86
6.李平,温海.隐球菌病的诊治进展.中国真菌学杂志[J],2011,6(3):186-189
7.周颖杰,李光辉.隐球菌病治疗实用指南[J].中国感染与化疗杂志,2007,7(1):11-13
8. Saag MS,Graybill RJ,Larsen RA,et al. Practice Guideline for the Management of Cryptococcal Disease. Clinical Infections Diseases 2000;30:710-718
9.Perfect JR,Dismkes WE,Goldman GL,et al. Clinical Practice Guidelines for the Management of Cryptococcal Disease:2010 Update by the Infectious Diseases Society of America.Clinical Infectious Diseases 2010;50:291-322
10.中华医学会感染病学分会.隐球菌性脑膜炎诊治专家共识[J].中华传染病杂志 2018;36(4):193-199
11.浙江省医学会热带病和寄生虫病分会艾滋病学组.艾滋病患者隐球菌感染筛查浙江省专家共识[J].中华临床感染病杂志 2019;12(2):81-86+106
四、起草单位
国家药品监督管理局医疗器械技术审评中心。

