【医疗器械注册申请】优先审批
一、适用情形
对符合下列条件之一的境内第三类和进口第二类、第三类医疗器械注册申请实施优先审批:
(一)符合下列情形之一的医疗器械:
1. 诊断或者治疗罕见病,且具有明显临床优势;
2. 诊断或者治疗恶性肿瘤,且具有明显临床优势;
3. 诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段;
4. 专用于儿童,且具有明显临床优势;
5. 临床急需,且在我国尚无同品种产品获准注册的医疗器械。
(二)列入国家科技重大专项或者国家重点研发计划的医疗器械。
(三)其他应当优先审批的医疗器械。
二、责任部门及责任事项
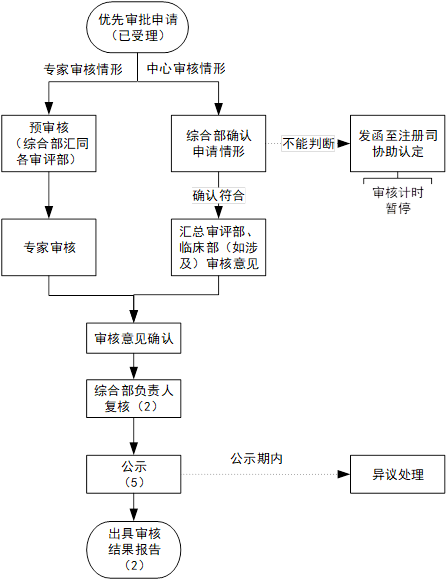
对于"一、适用情形"中第(一)项情形所述医疗器械优先审批申请,中心委托医学工程学会组织专家进行审核;
对于"一、适用情形"中第(二)项情形所述医疗器械优先审批申请,由综合业务部(优先审核办)进行审核。
综合业务部(优先审核办)按《医疗器械优先审批申请审核操作规范(试行)》相关要求对产品注册中附带优先审批申请的产品组织审核。对于经审核同意的优先审批申请,由综合业务部在审评系统中确认该项目进入优先通道,该项目自动解锁并转为小组审评项目,进行优先审评。
三、流程和时限
四、Tips
已经按照医疗器械应急审批程序、创新医疗器械特别审批程序进行审批的注册申请项目,不执行优先审批程序。
未确认可优先审批前,提交优先审批申请的注册申请项目暂按正常工作程序开展技术审评。
对于已纳入优先审评通道的医疗器械,在国家药监局、器审中心已发布实施的沟通交流机制保持不变的基础上,由器审中心定期更新产品清单并交换至分中心,分中心按照专人负责、主动对接、全程指导的工作机制,指派专人主动服务,给予指导。
五、相关文件
关于医疗器械审评检查长三角、大湾区分中心开展审评业务及器审中心咨询工作安排调整的通告(2021年第6号)
《医疗器械优先审批申请审核操作规范(试行)》(食药监械审发〔2017〕6号)
《医疗器械优先审批程序》(2016年第168号)