【医疗器械】应急产品技术审评
一、应急产品技术审评基本原则
中心按照既定审评操作规范及要点,根据"统一指挥、早期介入、随到随审、科学审批"的原则对应急产品进行技术审评。
二、责任部门
中心设立医疗器械应急审评项目组(以下称"应急项目组"),对应急产品开展审评工作。
三、应急产品审评流程
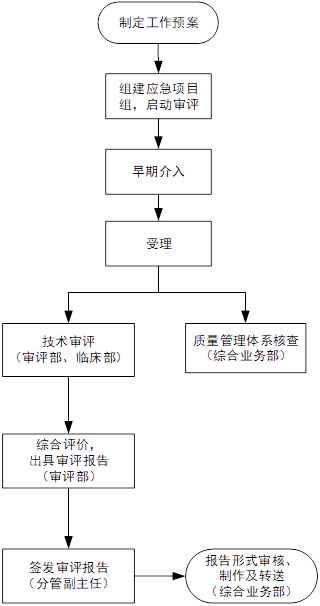
四、Tips
审评部、临床部可根据需要提出对应急产品上市后日常监管中需要重点关注的问题,包括但不限于:生产过程与批准文件的一致性、产品不良事件监测要求、临床应用情况及注册人需要完成任务情况。综合业务部进行汇总后报送国家药品监督管理局。
对于我国境内尚无同类产品上市的应急产品,审评部、临床部可结合工作实际,研究制定应急产品相关审评要点,适时予以公布,指导申请人按审评要点准备注册申报资料。
经审评部/临床部确认需要召开专家咨询会的,按《医疗器械技术审评中心专家咨询会/专家公开论证会操作规范》执行。如对参会专家有定向需求的,可由审评部/临床部指定专家,经分管副主任同意后,由综合业务部负责联系专家参会。
五、相关文件
《医疗器械应急审批程序》(国食药监械〔2009〕565号)
《医疗器械技术审评中心医疗器械应急审评操作规范(试行)》(药监械审发〔2020〕34号)
《医疗器械技术审评中心专家咨询会/专家公开论证会操作规范》(药监械审发〔2019〕37号)

