医疗器械细分赛道之CRO
医疗器械CRO是接受医疗器械研发生产企业或者组织的委托,代表委托方负责实施医疗器械上市过程中全部或部分的研发与医学试验,以获取商业性报酬的第三方组织。
CRO机构通常由熟悉药械研发过程和注册法律法规的专业化人才组成,具备规范的服务流程,在一定区域内拥有合作网络,可以帮助医疗器械生产企业降低研发投入、缩短研发周期、提高研发效率,降低研发失败的风险,加快上市审批流程。
医疗器械CRO行业概述
服务范围
医疗器械从研发到上市销售是一项高技术、高风险、高投入和长周期的复杂系统工程。
以诊断试剂类非豁免临床试验的医疗器械产品为例,产品从研发到上市销售要经过产线筹建、体系建立、工艺开发验证、原材料选型、样品生产、性能验证、注册检验、临床试验、定岗培训、体系考核、注册申报、产品获准注册、生产许可证申请等诸多环节。CRO机构在医疗器械开发的整个生命周期中扮演着重要角色。
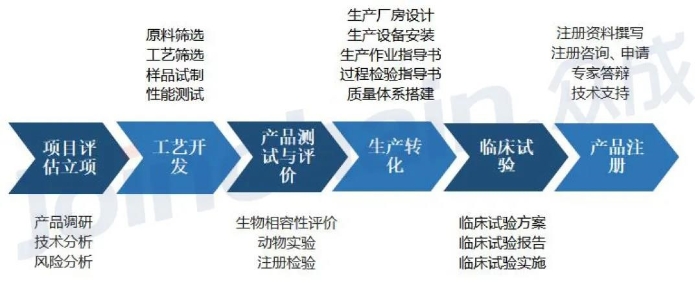
图1 医疗器械CRO开发流程与模块内容(资料来源:公开资料整理
行业政策
宏观监管环境日趋完善。我国相关医疗改革政策等将促进基层医疗机构发展及现有医疗卫生机构装备的更新换代,使得中国有望成为巨大的医疗器械消费市场。
同时,国家近年来也针对医疗器械行业推出一系列利好政策推动企业创新驱动发展和高端产品国产替代。
此外,带量采购、两票制、创新审批优先审批等的推行将大幅提升医疗器械行业集中度,有利于推动行业高质量发展。随着政策改革的深入推行,国内医疗器械产业宏观政策环境日趋完善。
注册人制使研发与生产解绑。医疗器械注册人制度是国际社会普遍采用的医疗器械管理制度,制度的实施实现生产与研发的解绑,有利于促进医疗器械企业、研发单位与CRO机构的合作,医疗器械CRO行业将迎来重大发展机遇。
2017年,国务院印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,标志着医疗器械上市许可持有人制度正式在国内开始施行。
2019年8月,国家药监局发布《关于扩大医疗器械注册人制度试点工作的通知》,将试点范围扩大至21个省市。截至2019年12月底,21个试点省市全部发布了医疗器械注册人制度实施方案。
鼓励认可专业服务价值。新的《医疗器械临床试验质量管理规范》以及医疗器械临床试验现场核查实践以“真实、规范”为核心,考虑医疗器械临床试验特点的同时,对临床试验的通用技术与新药临床试验要求保持一致。
这颠覆了对传统医疗器械临床试验的认识,生产企业难以在企业内部去维持这样一个庞大而专业的队伍来从事医疗器械临床试验工作,这将大大增加生产企业的人力负担,致使企业在医疗器械的审批注册时对器械CRO的需求快速上升。
国内医疗器械CRO市场规模
生物医药CRO市场规模。我国生物医药CRO行业虽起步较晚,但进入21世纪后,随着国内生物医药、创新型医疗器械、AI技术研发趋势凸显,生物医药CRO在研发中的价值得到极大体现,药明康德、睿智化学、泰格医药等一大批本土优秀CRO机构迅速崛起。
据统计,2018年,中国生物医药CRO市场规模达到678亿元,近三年复合增长率为21%;保守估计,未来2~3年中国生物医药CRO行业市场增幅在20%左右;到2020年,中国CRO市场规模将接近1000亿元。
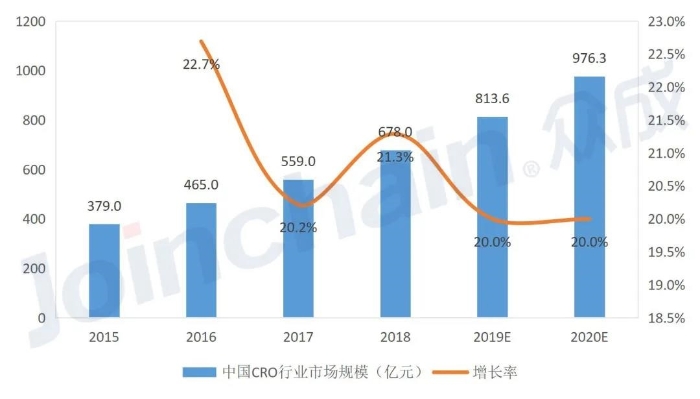
图2 2015~2020年中国生物医药CRO行业市场规模(数据来源:国家药监局南方医药经济研究所)
医疗器械CRO市场规模。作为世界医疗器械外包的热土,国内医疗器械CRO行业发展迅速。然而,目前国内医疗器械CRO机构业务主要集中在临床试验服务、注册技术服务与质量管理体系技术服务,且以临床试验CRO居多。
而且相比于医药临床试验CRO,医疗器械临床试验CRO的客单价较低。众成医械研究院预计,2020年国内医疗器械CRO市场规模在100亿元左右。
国内医疗器械CRO竞争格局
区域分布格局
根据众成医械研究大数据平台统计,截至2020年5月底,国内医疗器械CRO机构超过140家。按省份分布来看,北京医疗器械CRO机构达50家,位居国内首位。
上海以24家的数量位居其次,且与北京合计占比超50%;广东、江苏、浙江则分别达到12、10、10家。以上五个地区合计占比超过近70%,主要得益于这些地区生物医药产业发展成熟、研发资源丰富,以及教育资源与高端人才等创新动力充足等因素。
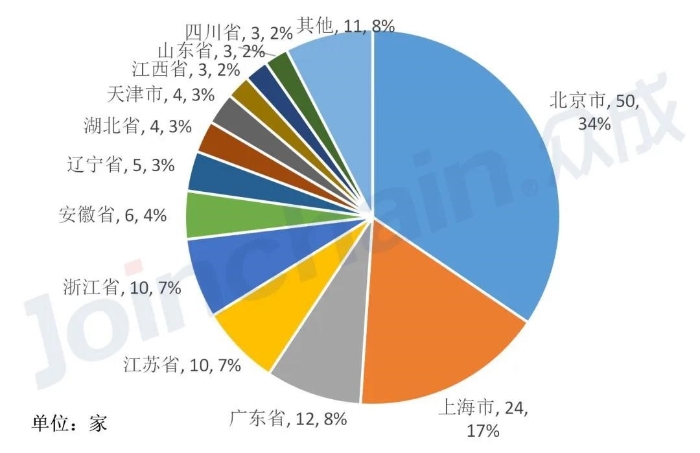
图3 2020年各省医疗器械CRO机构数量占比(数据来源:众成医械大数据平台)
市场竞争格局
目前国内医疗器械CRO行业小企业居多,营业收入和盈利能力普遍不高,市场份额相对分散。同时,由于医疗器械研发难度较大,目前国内医疗器械CRO机构业务主要集中在临床试验服务、医学翻译、质量管理体系技术服务以及注册代理服务。
国内医疗器械CRO机构主要以泰格捷通、奥咨达、迈迪思创、永铭医学、九泰药械、致众科技、汇通医疗、巨翊科技和盛恩(北京)等为代表。

