纳米材料医疗器械风险评估及标准研究概览
近年来,纳米材料、纳米技术及其在疾病诊疗中的应用研发获得迅猛发展。与传统医用材料相比,纳米材料凭借优越的纳米效应,在代谢动力学行为、被动或主动靶向性、降低毒副作用等方面具有明显优势。目前,国内外许多科研团队正在进行应用于医疗器械的纳米材料制备、生物学效应以及安全性研究,汇集多方合力,全力开创纳米材料医疗器械产品创新发展新局面。
一、纳米技术多点开花
随着纳米技术在医学领域广泛应用,国际上已经有一些纳米生物材料类医疗器械产品获批上市。我国在2004年前后开始有纳米材料医疗器械产品获批上市,主要包括纳米银抗菌产品等。
在国家药监局网站使用“纳米”或“Nano”作为关键词对国产医疗器械和进口医疗器械进行检索,发现应用纳米材料的医疗器械有效注册证中,数量***多的是含有纳米银的敷料类产品,其他还包括含有“远红外纳米级陶瓷粉”的纳米穴位敷贴、含有“纳米羟基磷灰石”的医用纳米羟基磷灰石/聚酰胺66复合骨充填材料、含有“NANOFILLED”填充材料的光固化树脂封闭剂、采用“Nano Hybrid”填充材料的通用树脂、含有“纳米填充材料”的自酸蚀粘结剂及含有“Nano-coated” 的一次性使用钝头闭合切割手术器械等。
在体外诊断试剂方面,已有含有“碳纳米管胶体金复合物”的人绒毛膜促性腺激素(HCG)快速检测试剂盒,基于胶体金法的乙型肝炎病毒表面抗体检测试剂、丙型肝炎病毒抗体检测试剂盒及戊型肝炎病毒I gM抗体检测试剂盒,基于胶体金法的吗啡/甲基安非他明/氯胺酮/亚甲二氧基甲基安非他明/四氢大麻酚酸/可卡因联合检测试剂盒,基于纳米顺磁颗粒与化学发光结合的免疫分析技术新型冠状病毒(2019-nCoV)抗体检测试剂盒,以及基于胶体金法的新型冠状病毒(2019-nCoV)抗体检测试剂盒等产品获批。
二、风险评估分层推进
由于纳米材料的比表面积等因素不同,生物体暴露于纳米材料后,可能表现出与常规材料不同的生物学反应。相较常规材料,纳米材料在样品制备时会有溶解性和分散性的区别,因此需要考虑纳米材料在样品制备时的特殊性。
纳米材料被认为可能穿越人体所有保护屏障,包括血脑屏障和胎盘屏障等,因此使用纳米材料时需要考虑纳米材料的全身毒性,特别是中枢神经毒性和生殖毒性。例如,“纳米分子冠”的形成可能会影响其生物响应、动力学、蓄积和毒性等生理效应;有些纳米材料具有类佐剂特性,可能会对免疫系统产生影响,需要关注免疫毒性;血液中纳米材料暴露时间间隔不同可能改变其毒代动力学特征等。基于此,针对应用纳米材料的医疗器械的生物学评价内容,在兼顾常规医疗器械评价内容的基础上,还应重点考虑与纳米材料有关的其他问题,如样品制备、吸收、分布、代谢和排泄/清除(ADME)、全身毒性、中枢神经毒性和免疫毒性等。
对应用纳米材料的医疗器械进行风险评估,***重要的考量因素是纳米材料从医疗器械中释放的可能性,应按照GB/T 16886.1要求进行风险评估。与纳米材料释放相关的风险评估阶段性方法包含四个阶段(见图)。
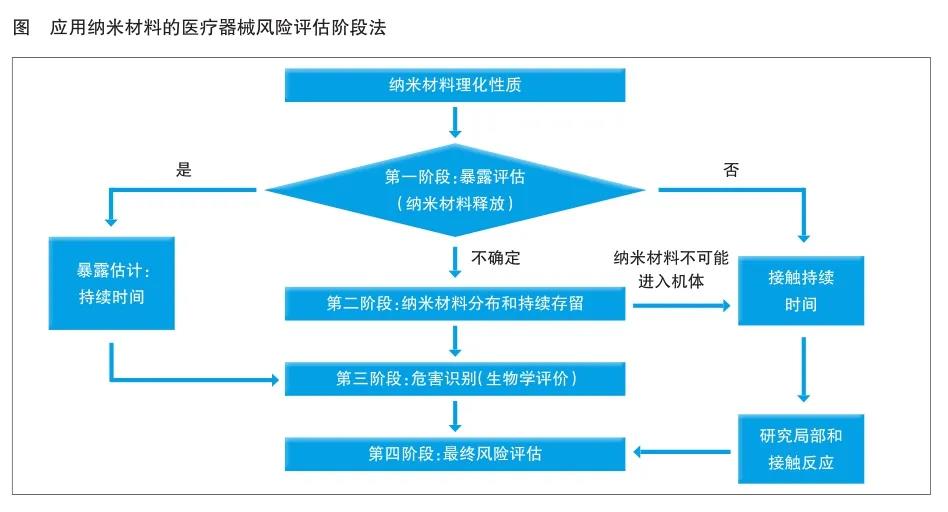
第一阶段:暴露评估(纳米材料释放)
第一阶段的目的,是模拟临床实际应用中***不利的情况下,基于材料的属性和应用类型,以及医疗器械植入后的磨损情况,评估纳米材料释放的可能性和潜在暴露风险。
当纳米材料存在释放的可能性时,需要根据理化表征确定释放材料的性质、释放速率和可能对其产生影响的因素,进一步开展生物学评价。如果纳米材料不存在释放的可能性,进一步评价可以仅限于局部反应。如果纳米材料存在潜在释放的不确定性,应开展第二阶段评估。
第二阶段:纳米材料分布和持续存留
这一阶段的主要目的,是识别纳米材料的生物分布和蓄积,可结合毒代动力学研究结果进行评估,以应对在第三阶段潜在暴露场景中所需的生物学评价。
无创伤(皮肤接触)和/或有创伤器械作用于人体部位所释放的纳米材料的吸收和接触持续时间,对纳米材料向其他器官的潜在分布具有重要影响,应进一步考虑纳米材料在其释放的生物介质中的持续存留/稳定性。
对于无创伤器械,首先需要评估纳米材料进入全身循环的潜力,如果能够得出在***差使用条件下,纳米材料都不可能进入全身循环,则通常仅需考虑限于接触部位的局部反应。对于有创伤器械,需要通过更详细的毒代动力学研究,评估纳米材料进入并保留在特定组织中的潜力。从以上研究中得出的结果,可能影响下一步生物学评价方法的选择。
第三阶段:危害识别(生物学评价)
如果第一阶段和/或第二阶段没有识别出纳米材料的释放,医疗器械的局部效应可以被GB/T 16886.1中已有的试验方法覆盖;如果存在纳米材料释放,则需要附加试验。如果根据第二阶段评估结果,判断纳米材料释放不太可能进入全身循环,则仅需进行局部效应的试验;如果纳米材料在一个或多个组织暴露,则应考虑附加试验,如免疫毒性、ADME、遗传毒性、亚慢性、慢性毒性、生殖毒性和神经毒性等试验。为了评估纳米材料的潜在风险,可能需要对现有的试验方法进行改进。
第四阶段:***终风险评估
当毒性由纳米材料引起时,必须对剂量效应关系给予特别关注。对在研究中的毒性反应与在靶器官(内部暴露)中检测到的纳米材料水平进行比较,以评价风险。评估的风险可以与不含纳米材料的医疗器械作对比,并根据YY/T 0316进行评估。除评估潜在风险外,在***终受益风险评价中也要考虑患者的潜在受益。
三、国际研究方兴未艾
关于医疗器械中应用纳米材料的评价方法、工具及手段目前均在研究中,并取得了一些进展。
在国际标准制订方面,国际标准化组织纳米技术委员会(I SO/TC229)正在研制的标准涵盖纳米技术相关术语和定义、纳米颗粒的职业暴露、样品准备、剂量考虑、毒理筛选方法、纳米材料分散与聚集对毒理学的影响、纳米器械产品中纳米材料的释放,以及采用3D细胞模型评价纳米材料的毒性方法等。国际标准化组织医疗器械生物学评价技术委员会(ISO/TC194)仅发布1项纳米相关技术报告:ISO/TR 10993-22:2017: Biological evaluati on ofmedicaldevices — Part 22: Guidance on nanomaterials(医疗器械生物学评价第22部分:纳米材料指南)。该报告全面考虑了应用于医疗器械领域的纳米材料及纳米技术可能带来的风险,并对如何评价这些风险给出了指导性建议,强调了在评估由纳米材料组成、包含和/或生成纳米材料的医疗器械的安全性时需要考虑的重要方面。作为一份技术报告,该文件明确了当前与纳米材料相关的技术知识,但没有列出详细的测试方法。
在我国,全国纳米技术标准化技术委员会(SAC/ TC279)已经发布112项纳米技术相关标准,主要涉及纳米材料术语、表征方法及指南等。但在生物学评价方面的技术内容仍然缺乏。已经发布的与医疗器械相关的标准包括:《GB/T 38261-2019:纳米技术 生物样品中银含量测量 电感耦合等离子体质谱法》《GB/T 36083-2018:纳米技术 纳米银材料 生物学效应相关的理化性质表征指南》《GB/T 34059-2017:纳米技术 纳米生物效应代谢组学方法 核磁共振波谱法》《GB/T 28044-2011:纳米材料生物效应的透射电子显微镜检测方法通则》《GB/T 20307-2006:纳米级长度的扫描电镜测量方法通则》。
全国医疗器械生物学评价标准化技术委员会(SAC/TC248)目前正在转化国际标准“ISO 10993.22-2017:医疗器械生物学评价 纳米材料指南”。
全国医疗器械生物学评价标准化技术委员会纳米医疗器械生物学评价分技术委员会(SAC/TC248/SC1)已经开展的标准化工作包括“纳米医疗器械生物学评价-纳米银敷料技术要求(2011年立项)”、YY/T 0993-2015《医疗器械生物学评价 纳米材料:体外细胞毒性试验(MTT试验和LDH试验)》、YY/T 1295-2015《医疗器械生物学评价 纳米材料:细菌内毒素试验》及YY/T 1295-2017《医疗器械生物学评价 纳米材料 溶血试验》。
在指导原则制订方面,国家药监局医疗器械技术审评中心(以下简称器审中心)牵头,国家纳米科学中心、广东粤港澳大湾区纳米技术创新研究院及中国食品药品检定研究院(以下简称中检院)正在联合编写包括《医疗器械中应用的纳米材料安全性和有效性评价框架指导原则(征求意见稿)》在内的系列指导原则。该系列指导原则在总体框架设计中,根据纳米技术快速发展的实际情况,按照纳米医疗器械安全性和有效性所涉及的评价领域,规划了纳米材料表征、体外替代测试/计算机模拟、生物相容性/毒理学评价、动物实验以及应用真实世界数据的临床和长期安全性评价等指导原则。该系列指导原则力求建立一个开放性框架,成为一个可以容纳纳米技术***新研究进展动态更新的评价体系,同时也在探索医用材料评价方法、工具和手段方面的现代化路径。目前,《应用纳米材料的医疗器械安全性和有效性评价第一部分:体系框架》已完成编写。
系统理解纳米生物材料的生物学效应,建立纳米安全客观评价方法体系,建立标准化纳米生物材料评价方法,既是纳米科技的重要前沿,也是各个国家和地区纳米科技可持续发展和保持国际竞争力的重要保障。我国在纳米科技领域的发展十分迅速。为支持相关产品的安全性、有效性和质量可控性评价,我国在纳米毒理学、基础纳米医学、纳米生物学等基础研究领域取得了重大进展。
目前,国家纳米科学中心与器审中心、中检院共建国家药监局纳米技术产品评价重点实验室。该重点实验室结合国家纳米科学中心的技术优势、器审中心的监管科学研究和实际监管评价需求以及中检院的医疗器械检验能力,建设优势互补、学科交叉的纳米医疗器械质量评价研究平台。重点实验室将围绕纳米科技产品/技术的有效性、产品质量、临床前安全评价和标准研制推广,尽快形成纳米医疗器械相关技术要求,构建产品检验检测体系,保障纳米医疗器械安全性及有效性,支撑新产品和新产业的高速发展,确保新技术、新产品的快速安全应用,保证创新医疗器械技术尽快造福于民。

