医疗器械临床试验EDC常见疑问
临床试验中,数据采集可分为传统的基于纸质病例报告表(CRF)和基于网络的电子病例报告表(eCRF)两种方式。其中,基于网络的eCRF也就是我们通常所了解的电子数据采集(Electronic Data Capture, EDC)。
目前,医疗器械临床试验由于起步晚等原因,尚处于从纸质向EDC转换的阶段,有部分申办方、研究者等临床试验相关人员对EDC的认识不足,甚至存在着一些误解。下面,针对这些常见的疑问进行解析。
1、什么是EDC?
电子数据采集(EDC)是一种基于计算机网络的用于临床试验数据采集的技术,通过软件、硬件、标准操作程序和人员配置的有机结合,以电子化的形式直接采集和传递临床数据。EDC应具备eCRF构建、数据保存和稽查轨迹、逻辑核查、数据质疑管理、源数据核查确认、电子签名、数据库的锁定、数据存储和导出等基本功能。
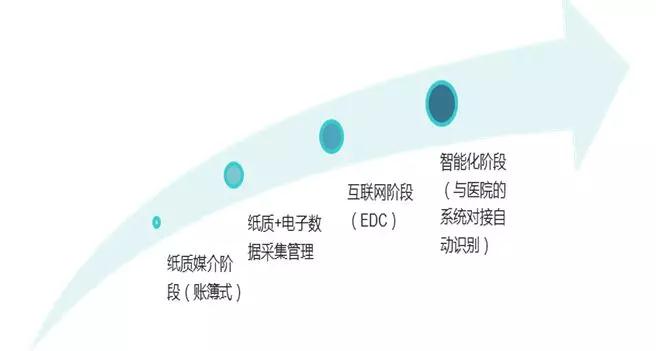
那我们所熟悉的纸质CRF与EDC之间有什么关联/区别。举个简单的例子,调查问卷的数据收集,电子问卷现今已基本替代以前纸质问卷的方式。纸质问卷需打印填写,收集填写完毕后需要整理录入,然后才能进行分析处理,而电子问卷可通过邮件/微信等网络途径收集,便可直接进行分析甚至直接得到结果。电子信息化时代,EDC是临床试验数据采集技术/方式发展的必然阶段,而且随着技术的进步,EDC正往功能更强大、更智能化的阶段发展,如与医院的HIS等系统对接自动识别采集数据,极大提高了数据采集效率和数据质量。至今,临床试验数据采集方式的发展历程可见下图。
2、EDC有什么法规支持?
临床试验的开展需严格遵循法规及相关指导原则的要求,自然,大家都很关注EDC相关法规的要求。
事实上,现今并没有现行法规把EDC使用作为强制性的要求。2016年,总局发布的《临床试验的电子数据采集技术指导原则》(114号)中,详细阐述了电子数据采集技术的概念和基本考虑,电子数据采集系统的基本技术要求以及在临床试验实施不同阶段的应用要求。国外也早已发布了相关的法规及指南,如:美国21号联邦法规第11部分(21 CFR Part 11)对电子记录和签名、计算机系统的验证、稽查轨迹,以及文件记录的复制等方面提出明确的要求。国内外EDC的主要相关法规详见图2。
信息技术***大益处在于提供**便利的情况下达到更规范化的标准,如上EDC介绍,EDC是技术的进步,是势不可挡的时代要求。十年前,我们普遍还在使用小灵通等按键手机,现今智能手机已全面替代并且更新换代极为迅速,没有任何法制的要求我们必须使用什么类型的手机,但时代会要求。在美国,现在已经有80%以上的临床试验在使用EDC,并且随着EDC相关技术的发展,EDC的使用比例还会继续上升[1]。在临床试验快速发展、规范化要求日益提高的阶段,纸质CRF的采集方式已显得捉襟见肘,EDC终将成为必然。

3、EDC系统花费高,没必要?
EDC系统由于技术要求及开发成本高等原因,通常由科技公司开发并以为临床试验单一项目独立租赁系统平台的方式进行供应及运维。目前,国际一致认可,功能完善***为成熟的是以下三大系统:系统甲骨文公司的Oracle Clinical (OC)/RDC系统,PhaseForward公司开发的InForm(目前已经被甲骨文公司收购)以及美国MediData的Rave系统。但由于系统的价格不菲,因而主要是一些实力雄厚的制药企业和CRO公司使用。实际上,国产EDC系统现今发展已非常迅速,如北京百奥知,太美医疗等系统,已符合国际规范的要求,且价格适中,因而在国内也很受青睐。但即便性价较优的国产系统,单项目平台服务费用也需10-20万左右,因而申办者仍抱着能省则省的态度,此顾虑为正常反应但应及时打消。
时间价**。资料显示,相比于纸质CRF,采用EDC减少了传统模式中需回收纸质CRF、繁琐的中心答疑等步骤,一个临床试验周期通常可缩短2 ~ 3 个月的时间[2]。临床试验周期是试验的成本主要影响因素之一,试验周期越长,投入的成本越高,其实延误一个月的人力成本就已高于EDC的费用。
质量更无价。数据质量和真实完整性是对整个临床试验的有效性和安全性进行正确评价的基础,是药品监管科学的核心要素。首先,没有记录就没有发生,过程重现是数据真实完整的重要体现,而EDC自动痕迹的核心功能(何时、谁、修改了什么等信息),实现了数据采集过程全面详细的记录。同时,EDC可实时自动逻辑核查,使得数据错误在产生时便可迅速反应并跟进解决,大大减少了质疑数量,提高了数据的可靠性。此外,EDC通过账户及权限的分配功能,把数据管理员、临床监查员、临床协调员、研究者、申办者等运行并把控试验质量的各方串联了起来,提供了直接沟通的平台,打破了以往各方之间如数据管理员与机构人员的沟通壁垒。这些功能均提高了数据质量。
数据质量和真实性完整性的要求现今每年都在提高,我们不仅仅要关注眼下,更要着将来,毕竟一个临床试验的周期至少也要2-3年。数据采集过程,EDC是技术的进步,更是临床试验规范化发展的要求,不仅可降低试验成本,更重要的是提高了数据质量,我们有何理由不拥抱它。

