医疗器械软件研发公司需要建立软件可追溯性分析过程吗?软件可追溯性分析的重要性
医疗器械软件研发公司需要建立医疗器械软件可追溯性分析过程吗?医疗器械软件可追溯性。医疗器械软件可追溯性分析作为医疗器械软件验证、医疗器械软件确认的重要活动之一,是指追踪医疗器械软件需求、医疗器械软件设计、源代码、医疗器械软件测试、医疗器械软件风险管理之间的关系,分析已识别关系的正确性、一致性、完整性、准确性。
医疗器械软件生存周期过程均应开展医疗器械软件可追溯性分析,详见医疗器械软件可追溯性分析流程图。医疗器械软件需求分析追溯分析医疗器械软件需求与产品需求、医疗器械软件需求与风险分析的关系。医疗器械软件设计追溯分析医疗器械软件设计与医疗器械软件需求、医疗器械软件设计与风险控制的关系。医疗器械软件编码追溯分析源代码与医疗器械软件设计、源代码与测试用例的关系。内部测试追溯分析单元测试、集成测试、系统测试各级测试用例与医疗器械软件设计,系统测试与医疗器械软件需求,系统测试与风险管理的关系。用户测试追溯分析用户测试与产品需求、用户测试与风险管理的关系。医疗器械软件更新亦应开展医疗器械软件可追溯性分析。
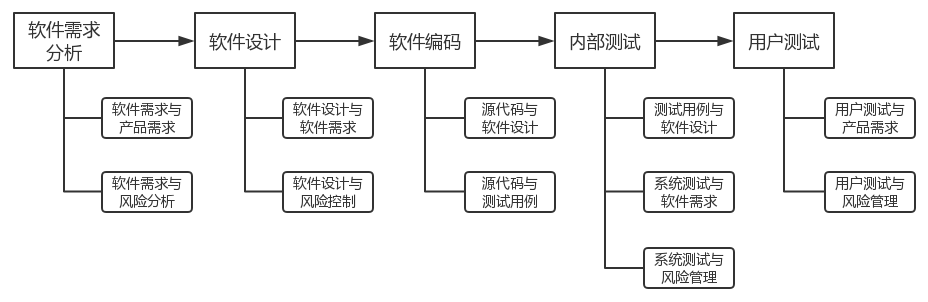
医疗器械软件可追溯性分析流程图
生产企业需建立医疗器械软件可追溯性分析过程,以规范医疗器械软件可追溯性分析相关活动要求,以保证医疗器械软件验证、医疗器械软件确认的质量。

