脑外科影像处理软件是几类医疗器械(关于医疗器械软件注册备案知识分享)
脑外科影像处理软件是几类医疗器械?该软件怎么做注册备案,本文就是一篇关于医疗器械软件注册备案知识分享文章,希望本篇文章分享能帮助到你!
首先根据国家药监局公布的脑外科影像处理软件注册备案数据来看一些信息。脑外科影像处理软件产品可将CT、磁共振产生的标准DICOM图像转化为三维影像,直观展现病灶状态及与周围脏器、组织、血管等的空间位置关系。由安装光盘组成,模块包括:平面处理模块、三维处理模块等。该软件用于对符合DICOM标准的脑外科医学图像(CT、MR数据)进行三维重建等后处理。其中管理类别为第二类,也就是说,该软件为第二类医疗器械软件详细数据看下图:
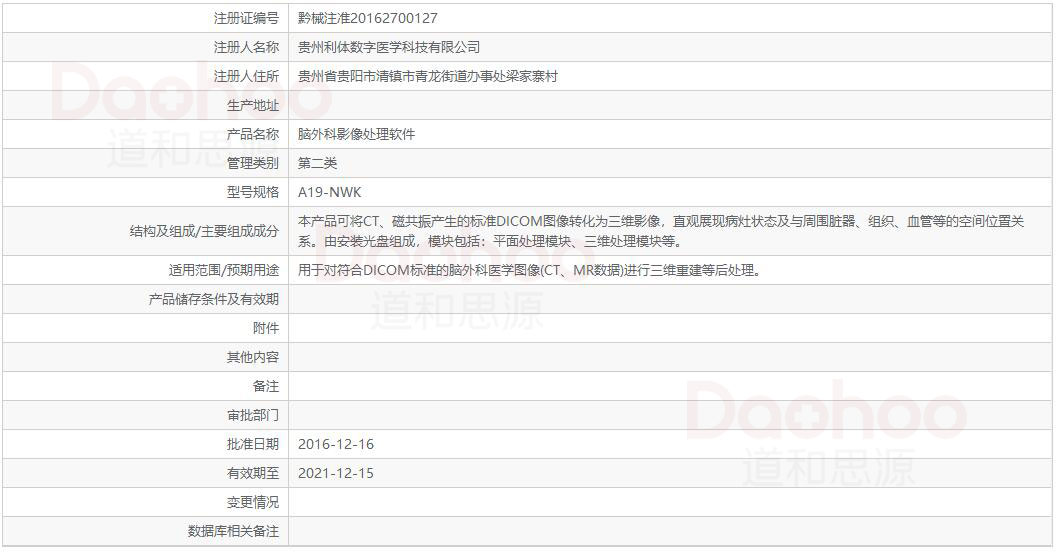
数据来源国家药监局
既然知道脑外科影像处理软件是属于第二类医疗器械了,那么第二类医疗器械软件注册证该怎么申请注册呢?软件的医疗器械软件注册和其他的医疗器械软件注册有什么区别吗?别着急继续往下看。
1、先回答一下软件的医疗器械软件注册和其他医疗器械软件注册有什么区别吗?
告诉你,没有区别,只是软件注册也需要根据软件相关的指导原则以及软件的一些标准来做,毕竟每种医疗器械,它的注册是不一样的,但不会有太大的变化。流程都不会变。
2、第二类医疗器械软件怎么注册申报
说注册申报,本文从第二类医疗器械软件注册的受理条件和申请的材料要求来说说,顺带我会附上办理流程图。
(1)第二类医疗器械软件注册的受理条件
已按照有关规定取得企业工商登记。已确定申报产品为第二类医疗器械,已编制完成拟申请产品的医疗器械产品技术要求,并已通过预评价已具备拟注册产品的生产能力;已按照《医疗器械生产质量管理规范》的要求建立医疗器械生产质量管理体系。已取得医疗器械检测机构出具的医疗器械检测报告。办理医疗器械软件注册申请的人员具有相应的专业知识,熟悉医疗器械软件注册管理的法规、规章和有关的技术要求。
(2)第二类医疗器械软件注册的申请材料要求
先明确一下,这里说的是第二类医疗器械首次注册的,跟延续和变更的无关。
1.境内医疗器械软件注册申请表;
2.资格证明;
3.产品技术要求;
4.安全风险分析报告;
5.适用的产品标准及说明;
6.产品性能自测报告;
7.医疗器械检测机构出具的产品注册检测报告;
8.医疗器械临床试验资料;(如需)
9.医疗器械说明书;
10.产品生产质量体系考核(认证)的有效证明文件——根据对不同产品的要求,提供相应的质量体系考核报告;
11.申请人应当对其所提交材料真实性的自我保证声明;
12.申请人不是法定代表人或负责人本人,企业应当提交《授权委托书》2份;
13.按申请材料顺序制作目录,如需提交软盘的,一并提交有效的软盘资料。
以上就是第二类医疗器械软件注册的材料要求,如果觉得申报注册很麻烦,也可以选择专业的CRO公司进行代理注册。
3、第二类医疗器械软件注册证办理流程图
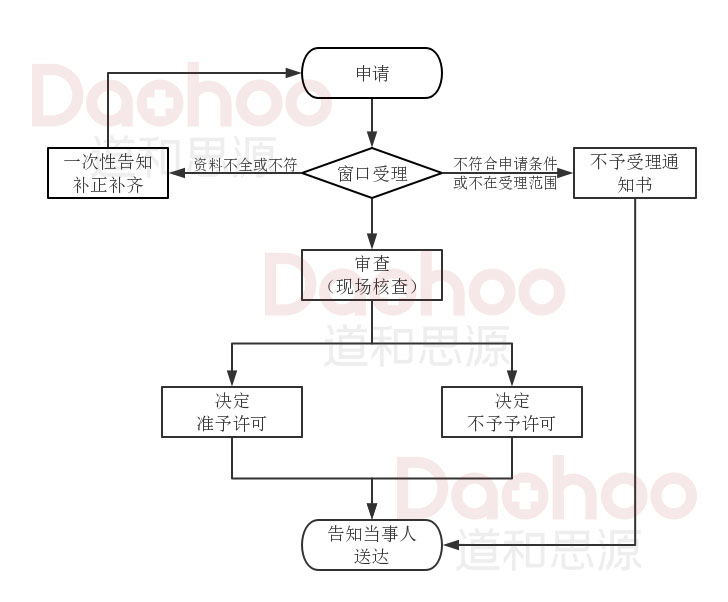
第二类医疗器械软件注册证办理流程图

