一次性使用手术衣医疗器械产品注册标准及技术要求
日期:2020-07 / 人气:150一次性使用手术衣产品做医疗器械注册,其注册适用标准YY0506-2009《病人、医护人员和器械用手术单、手术衣和洁净服》系列标准中的手术衣在《医疗器械分类目录》中为第二类医疗器械产品。
手术衣产品名称的要求,产品名称应以预期用途为依据命名,产品名称为一次性使用手术衣。
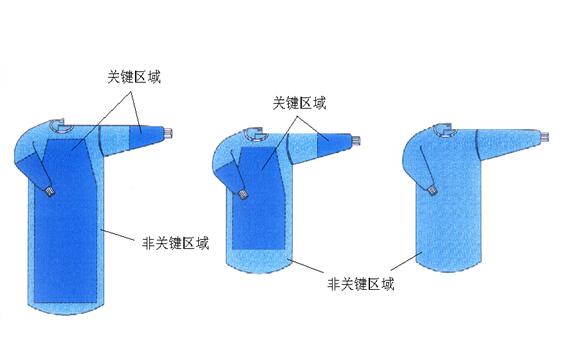
手术衣产品的结构和组成
一次性使用手术衣为手术人员穿着以防止感染原传播的长袍,由前身、后身、袖子、系带等组成。
医疗器械一次性使用手术衣医疗器械产品注册适用标准:
GB 15980-1995 一次性使用医疗用品卫生标准
GB 18278-2000 医疗保健产品灭菌确认和常规控制要求 工业湿热灭菌
GB 18279-2000 医疗器械 环氧乙烷灭菌确认和常规控制
GB 18280-2000 医疗保健产品灭菌确认和常规控制要求 辐射灭菌
GB/T 16886.1-2001 医疗器械生物学评价 第1部分:评价与试验
GB/T 16886.7-2001 医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量
GB/T 16886.10-2005 医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验
GB/T 19633-2005 最终灭菌医疗器械的包装
GB/T 14233.1-2008 医用输血、输液、注射器具检测方法 第1部分:化学分析方法
GB/T 14233.2-2008 医用输血、输液、注射器具检测方法 第2部分:生物试验方法
YY/T 0313-1998 医用高分子制品包装、标志、运输和贮存
YY/T 0287-2003 医疗器械 质量管理体系用于法规的要求
YY 0466-2003 医疗器械 用于医疗器械标签、标记和提供信息的符号
YY/T 0615.1-2007 标示“无菌”医疗器械的要求 第1部分:最终灭菌医疗器械的要求
YY/T 0316-2008 医疗器械 风险管理对医疗器械的应用
YY /T 0506.1 病人、医护人员和器械用手术单、手术衣和洁净服第1部分:制造厂、处理厂和产品的通用要求
YY /T 0506.2 病人、医护人员和器械用手术单、手术衣和洁净服第2部分:性能要求和性能水平
YY /T 0506.3 病人、医护人员和器械用手术单、手术衣和洁净服第3部分:试验方法
YY /T 0506.4 病人、医护人员和器械用手术单、手术衣和洁净服第4部分:干态落絮试验方法(ISO 9073-10:2003,IDT)
YY /T 0 506.5 病人、医护人员和器械用手术单、手术衣和洁净服第5部分:阻干态微生物穿透试验方法
YY /T 0506.6 病人、医护人员和器械用手术单、手术衣和洁净服第6部分:阻湿态微生物穿透试验方法
中华人民共和国药典
医疗器械注册代理产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品标准时与产品相关的国家、行业标准是否进行了引用,以及引用是否准确。可以通过对注册产品标准中“规范性引用文件”是否引用了相关标准,以及所引用的标准是否适宜来进行审查。此时,应注意标准编号、标准名称是否完整规范,年代号是否有效。
医疗器械注册办理其次对引用标准的采纳情况进行审查。即所引用标准中的条款,是否在注册产品标准中进行了实质性的条款引用。这种引用通常采用两种方式,内容繁多的、复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
医疗器械产品注册代理如有新版国家标准、行业标准发布实施,应执行最新版本的国家标准、行业标准。
一次性使用手术衣产品的预期用途:
一次性使用手术衣用于防止手术过程和其他有创检查中病人和医护人员之间感染原的传播。
一次性使用手术衣按性能水平分为高性能和标准性能两种。
高性能手术衣:适用于病人血液中已知有传染性病毒或紧急抢救时未知血液中是否有传染性病毒的手术。
标准性能手术衣:适用于已知病人血液中无传染性病毒的手术。
一次性使用手术衣医疗器械产品注册的主要技术指标
医疗器械注册一次性使用手术衣产品注册的主要技术指标,一次性使用手术衣产品需要评价的性能要求,其中部分性能要求给出了定量要求,其他性能要求企业可参考相应的国家标准、行业标准,根据企业自身产品的技术特点制定相应的要求,但不得低于相关强制性国家标准、行业标准的有关要求。如有不适用条款(包括国家标准、行业标准要求),企业在标准的编制说明中必须说明理由。
1.规格尺寸
医疗器械产品注册企业应明确指出申报产品所包含的规格尺寸和允差要求。
2.YY/T0506-2009《病人、医护人员和器械用手术单、手术衣和洁净服》中性能要求见下表:
| 性能名称 | 单位 | 要求 | ||||
| 标准性能 | 高性能 | |||||
| 产品关键区域 | 产品非关键区域 | 产品关键区域 | 产品非关键区域 | |||
| 阻微生物穿透,干态 |
Log10 CFU |
不要求 | ≤2a,c | 不要求 | ≤2a,c | |
| 阻微生物穿透,湿态 | IB | ≥2.8b | 不要求 | 6.0b,d | 不要求 | |
| 洁净度,微生物 | Log10(cfu/dm2) | ≤2c | ≤2c | ≤2c | ≤2c | |
| 洁净度,微粒物质 | IPM | ≤3.5 | ≤3.5 | ≤3.5 | ≤3.5 | |
| 落絮 | Log10(落絮计数) | ≤4.0 | ≤4.0 | ≤4.0 | ≤4.0 | |
| 抗渗水性 | cmH2O | ≥20 | ≥10 | ≥100 | ≥10 | |
| 胀破强度,干态 | kPa | ≥40 | ≥40 | ≥40 | ≥40 | |
| 胀破强度,湿态 | kPa | ≥40 | 不要求 | ≥40 | 不要求 | |
| 拉伸强度,干态 | N | ≥20 | ≥20 | ≥20 | ≥20 | |
| 拉伸强度,湿态 | N | ≥20 | 不要求 | ≥20 | 不要求 | |
医疗器械注册代理注:a试验条件:挑战菌浓度为108CFU/g滑石粉,振动时间为30min。
b用YY/T0506.6试验时,在95%的置信水平处的IB的最小显著性差异为0.98。这是区分两个材料之间有所不同的最小差异。小于等于0.98IB的材料变动可能无差异;而大于0.98IB则可能有差异(95%的置信水平意味着进行20次试验,至少有19次是正确的)。
c在本部分中log10(CFU≤2)意味着最大300CFU。
d本部分中IB=6.0时,意味着无穿透。IB=6.0是最大可接受值。
3.医疗器械产品注册代理其它性能指标
(1)粘合或缝制要求
粘合或缝制部位的性能应符合标准要求。
(2)无菌要求
一次性使用手术衣应无菌供应,应经过一个确认过的灭菌过程使其无菌。
(3)化学性能要求
一次性使用手术衣若采用环氧乙烷灭菌,环氧乙烷残留量应不大于 10 mg/kg。
(4)生物性能要求
一次性使用手术衣对皮肤应无刺激与迟发型超敏反应。
(5)结构要求
如有系带应规定系带长度、系带固定的牢固度等。
4.医疗器械注册咨询一次性使用手术衣的透气性对产品的使用和手术质量的保证非常重要,考虑到目前对产品的透气性指标提出一个统一要求的依据不够充分,制造商应结合临床具体应用对产品的透气性进行评价,并对各区域标示透气性指标。
产品的检验要求
产品的检验包括出厂检验和型式检验。
出厂检验应至少包括环氧乙烷残留量(若采用环氧乙烷灭菌)、无菌。
医疗器械产品注册办理型式检验报告是证实生产过程有效性的文件之一。注册申请时进行的型式检验应由具备合法资质的检验机构进行。型式检验时,若标准中无特殊规定,按相应的标准要求进行全性能检验,应全部合格。
一次性使用手术衣产品的临床要求
一次性使用手术衣产品设计定型、工艺成熟,临床应用多年,不改变常规用途,且无严重不良事件记录,通过非临床评价、注册检验及质量体系考核能够保证产品的安全性、有效性,故原则上不要求临床试验。

道和思源(北京)科技有限公司成立于2014年,专注于医疗器械法规咨询服务,致力于为客户将安全、有效和合规的医疗器械产品迅速推向并占领全球市场,是中国领先的医疗器械CRO创新服务企业。主要服务项目有:进口一类医疗器械备案、进口二类医疗器械注册、进口三类医疗器械注册、国产三类医疗器械注册、医疗器械软件注册、临床实验、创新医疗器械申报港澳台医疗器械注册等。
猜你喜欢的内容
- 医用降温贴2021-06-18
- 鼻组织钳2021-06-24
- 铜绿假单胞菌和鲍曼不动杆菌敏试剂盒(微量肉汤2021-06-23
- 医用外固定支具2021-07-09
- 牙骨锤 Mallet2021-05-18
- 医疗器械注册证查询2020-07-16
- 手摇式病床2021-04-25
- 微型腹部外科手术器械2021-05-12
- 线锯导引器2021-06-22
- 医疗器械注册管理办法2020-04-27
- 一次性使用输液器 带针2021-06-23
- 金属接骨螺钉2021-04-25
- 02 无源手术器械-04 手术器械钳2020-07-17
- 软组织环切刀 Tissue Punch2021-04-27
- 甲状腺手术器械2021-06-24
- 鹅头钉组合铰刀2021-05-06

















